Sejarah Berilium, Struktur, Properti, Penggunaan

- 3988
- 977
- Tommie Smith
Dia berilium Ini adalah elemen logam yang dimiliki kelompok 2 atau IIa dari tabel periodik. Ini adalah logam alkali paling ringan dalam kelompok, dan diwakili oleh simbol BE. Atom dan kationnya juga lebih kecil dari rekan -rekan mereka (mg, ca, mr ...).
Karena kepadatan beban yang tidak biasa, logam ini biasanya tidak terjadi secara terpisah. Mereka tahu sekitar 30 mineral yang mengandungnya, di antaranya adalah: beryl (3beo · al2SALAH SATU3· 62· 2h2O), Bertrandita (4beo.2se2.2h2O), El Chrisoberilo (Beal2SALAH SATU4), dan fenaquita (be2Ya4).
 Pipitas Beryll Metalik. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Pipitas Beryll Metalik. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] La Esmeralda, batu berharga, adalah varian dari beryl. Namun, berilium murni tidak begitu mencolok; Ini terlihat kecerahan keabu -abuan pucat (gambar superior), dan telah dicapai dalam bentuk pepitas atau drage.
Berilium memiliki serangkaian sifat fisik yang khas. Ini memiliki kepadatan rendah; perilaku termal dan listrik yang tinggi, serta kapasitas termal dan disipasi panasnya; Ini bukan logam magnetik; dan juga memiliki kombinasi kekakuan dan elastisitas yang tepat.
Semua sifat ini telah menyebabkan berilium menjadi logam dengan banyak aplikasi, mulai dari penggunaannya pada paduan tembaga untuk elaborasi alat, hingga penggunaannya dalam roket, pesawat terbang, mobil, reaktor nuklir, peralatan x -ray, magnetik nuklir resonansi, dll. .
Berilium memiliki 10 isotop yang diketahui, mulai dari 5Jadilah a 14Jadilah, menjadi 9Menjadi satu -satunya stabil. Ini juga merupakan logam yang sangat beracun, yang terutama mempengaruhi sistem pernapasan, jadi ada batasan penggunaannya.
[TOC]
Sejarah Penemuan Anda
Berilium ini ditemukan oleh Louis-Nicolas Vauguelin pada 1798 sebagai elemen komposisi dari mineral Berilo, dan aluminium dan berilium silikat.
Selanjutnya, ahli kimia Jerman Frederic Wöhler, pada tahun 1828, berhasil mengisolasi berilium dengan bereaksi kalium dengan berilium klorida dalam pot platinum.
Secara bersamaan, dan mandiri, ahli kimia Prancis Antoine Bussy juga mencapai isolasi berilium. Wöhler adalah orang pertama yang menyarankan nama berilium untuk logam.
Dia menerima namanya saat ini pada tahun 1957, karena dia sebelumnya dikenal sebagai Glucinium, karena rasa manis dari beberapa garam. Tapi, untuk menghindari kebingungan dengan senyawa rasa manis lainnya, dan dengan tanaman yang disebut glucina, diputuskan untuk mengubah nama untuk berilium.
Struktur Berikakan
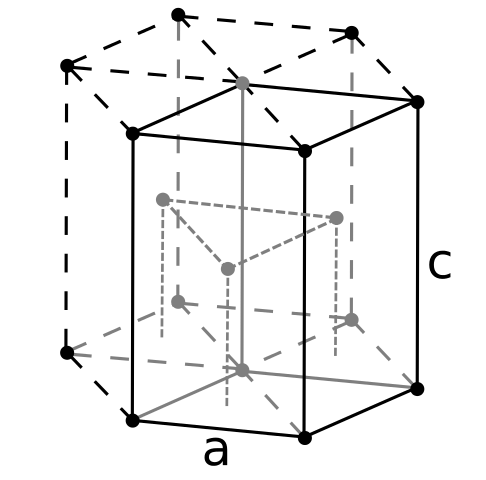 Struktur Berdiri Berdaya. Sumber: Pengguna: Dornelf [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Struktur Berdiri Berdaya. Sumber: Pengguna: Dornelf [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Menjadi beryl yang paling ringan dari logam alkalinoterus, harus diharapkan bahwa volume atomnya akan menjadi yang terkecil dari semuanya. Atom berylil berinteraksi satu sama lain melalui ikatan logam, sehingga "lautan elektron" dan penolakan antara nuklei memodelkan struktur kaca yang dihasilkan.
Itu dapat melayani Anda: asam periódic (HIO4): apa itu, struktur, sifat, penggunaanKristal hitam berilium kemudian terbentuk. Kristal -kristal ini memiliki struktur heksagonal (gambar superior), di mana masing -masing memiliki enam tetangga sisi, dan tiga lainnya di bidang atas dan bawah.
Menjadi kristal hitam, bermanfaat. Ini adalah salah satu struktur paling ringkas yang dapat diadopsi logam; Dan masuk akal bahwa atom yang begitu kecil dari menjadi "memeras" keduanya untuk menghindari jumlah kekosongan atau jumlah lubang di antara mereka.
Konfigurasi elektronik
1s22s2
Apa yang sama dengan 4 elektron, yang 2 berasal dari Valencia. Jika elektron ke orbital 2p dipromosikan, dua orbital sp hbíbridos akan memiliki. Dengan demikian, dalam senyawa berilium mungkin ada geometri linier, X-be-x; Misalnya, molekul BECL yang terisolasi2, CL-BE-CL.
Properti
Deskripsi Fisik
Warna abu -abu solid, cerah dan rapuh.
Titik lebur
1287 ºC.
Titik didih
2471 ºC.
Kepadatan
- 1.848 g/cm3 pada suhu kamar.
- 1,69 g/cm3 ke titik leleh (keadaan cair).
Radio atom
112 PM.
Kovalen radio
90 sore.
Volume atom
5 cm3/mol.
Panas spesifik
1.824 j/g · mol pada 20 ºC.
Panas fusi
12.21 kJ/mol.
Panas penguapan
309 kJ/mol.
Elektronegativitas
1.57 pada skala Pauling.
Potensi standar
1.70 v.
Kecepatan suara
12.890 m/s.
Ekspansi termal
11,3 μm/m · k pada 25 ° C.
Konduktivitas termal
200 w/m · k.
Sifat kimia
Berilium ditutupi dengan lapisan beryl oksida (BEEO) yang berfungsi sebagai perlindungan udara pada suhu kamar. Oksidasi berilium terjadi pada suhu lebih besar dari 1000 ºC, yang berasal dari produk berilium oksida dan berilium nitrida.
Ini juga tahan terhadap aksi asam nitrat 15 m. Tapi, larut dalam asam klorida dan alkali, seperti natrium hidroksida.
Aplikasi
Persiapan alat
Berilium membentuk paduan dengan tembaga, nikel dan alumino. Khususnya paduan dengan tembaga menghasilkan alat dengan kekerasan dan resistensi yang besar, hanya merupakan 2% dari berat paduan.
Alat -alat ini tidak menghasilkan percikan api saat mengenai besi, yang memungkinkannya untuk digunakan di lingkungan dengan kandungan gas yang mudah terbakar tinggi.
Dapat melayani Anda: termal: struktur, karakteristik, pembentukan, contohKarena kepadatannya yang rendah, ia memiliki bobot yang ringan, yang, bersama dengan kekakuannya, memungkinkan penggunaannya dalam pesawat ruang angkasa, roket, rudal, dan pesawat terbang. Paduan dengan berilium telah digunakan dalam elaborasi bagian mobil. Itu juga telah digunakan dalam elaborasi pegas.
Karena kekerasan besar yang diberikan oleh berilium pada paduannya, ini telah digunakan dalam rem pesawat militer.
Elaborasi Cermin
Berilium telah digunakan dalam produksi cermin karena stabilitas dimensinya dan kemampuannya untuk memiliki pulter tinggi. Cermin ini digunakan dalam satelit dan sistem kontrol kebakaran. Selain itu, teleskop ruang digunakan.
Dalam radiasi pengion
Berilium adalah elemen kepadatan rendah, sehingga dapat dianggap transparan ke x -rays. Fitur ini memungkinkan penggunaannya dalam pembangunan jendela tabung yang menghasilkan x -rays, aplikasi industri dan diagnosis medis.
Demikian juga, berilium digunakan di jendela detektor emisi radioaktif.
Dalam tim yang menghasilkan magnetisme
Di antara karakteristik berilium, tidak menjadi elemen magnetik. Ini memungkinkannya untuk digunakan dalam konstruksi barang -barang peralatan resonansi magnetik, di mana medan magnet intensitas besar dihasilkan, meminimalkan gangguan apa pun.
Reaktor nuklir
Karena titik fusi yang tinggi, ia telah menemukan aplikasi dalam reaktor nuklir dan keramik. Berilium digunakan sebagai moderator reaksi nuklir dan sebagai produsen neutron:
9Menjadi + 4Dia (α) => 12C +n (neutron)
Diperkirakan bahwa untuk sejuta atom beryl yang dibom dengan partikel α, hingga 30 juta neutron terjadi. Justru reaksi nuklir ini memungkinkan penemuan neutron.
James Chadwick membombardir atom berilium dengan partikel α (dia). Peneliti mengamati pelepasan partikel subátomic, tanpa muatan listrik, yang mengarah pada penemuan neutron.
Pelindung logam
Tambahkan sejumlah berilium pada permukaan logam yang dapat dioksidasi, memberikan perlindungan tertentu. Misalnya, kemampuan terbakar magnesium berkurang dan kecerahan paduan perak berkepanjangan.
Di mana letaknya?
Beryl ditemukan di pegmatite, terkait dengan mika, feldspar dan kuarsa. Melalui penggunaan teknik flotasi, dimungkinkan untuk memisahkan campuran beryl dan feldspar. Selanjutnya, feldspar dan beryl terkonsentrasi dan mengalami perlakuan dengan kalsium hipoklorit.
Itu dapat melayani Anda: Perbedaan antara senyawa organik dan anorganikDiikuti oleh perlakuan dengan asam sulfat dan kalium sulfonat, melalui pengenceran, flotasi beryl tercapai, memisahkannya dari feldspar.
Beryl diobati dengan natrium fluorosilikat dan soda pada 770 ºC untuk membentuk natrium fluoroberilate, aluminium oksida dan silikon dioksida. Kemudian berilium hidroksida dari larutan natrium hidroksida hidroksida fluorroberile diendapkan.
Berilium fluorida dibentuk dengan bereaksi beryl hidroksida dengan ammoniacal hydrogen fluoride, menghasilkan amonium amonium. Ini dipanaskan untuk membentuk berilium fluoride, yang diobati dengan magnesium panas untuk mengisolasi berilium.
Risiko
Berilium sebagai logam yang terbagi halus, dalam bentuk larutan, debu kering atau asap, sangat beracun dan dapat menghasilkan dermatitis. Namun, toksisitas terbesar dihasilkan oleh inhalasi.
Awalnya, berilium dapat menginduksi hipersensitivitas atau alergi, yang dapat menjadi belliosis atau penyakit kronis berilium (CBD). Ini adalah penyakit serius, ditandai dengan penurunan kapasitas paru -paru.
Penyakit akut jarang terjadi. Pada penyakit kronis ada pembentukan faruloma di seluruh tubuh, terutama di paru -paru. Belliosis kronis menyebabkan dispnea progresif, batuk dan kelemahan umum (asthenia).
Belliosis akut bisa mematikan. Dalam Belliosis, hilangnya fungsi pernapasan progresif, karena ada obstruksi dalam aliran saluran udara di saluran pernapasan dan penurunan oksigenasi tekanan darah darah.
Referensi
- Royal Society of Chemistry. (2019). Berilium. Pulih dari: rsc.org
- Pusat Nasional Informasi Bioteknologi. (2019). Berilium. Database pubchem. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Helmestine, Anne Marie, PH.D. (15 Maret 2019). Fakta Beryllium. Pulih dari: thinkco.com
- Wikipedia. (2019). Berilium. Diperoleh dari: di.Wikipedia.org
- Lentech b. V. (2019). Beryllium-be. Pulih dari: lentech.com
- Materi korporasi. (2019). Pelajari tentang elemen berilium yang dipulihkan dari: beryllium.com
- D. Michaud. (12 April 2016). Masalah pemrosesan & ekstraksi berilium. 911 Metalurgi. Dipulihkan dari: 911Metalurgiist.com
- Timothy p. Hanusa. (5 Januari 2016). Berilium. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Baca s. Orang baru. (2014). Penyakit berilium. Manual MSD. Pulih dari: msdmanuals.com
- « Sejarah Psikologi Olahraga, Tujuan dan Profil
- Globalisasi Sosial Dimensi Sosial, Keuntungan dan Contoh »

