Struktur Berkelio (BK), properti, memperoleh, menggunakan

- 4660
- 848
- Jessie Harvey
Dia Berkelium Itu adalah elemen kimia yang simbolnya bk. Itu milik kelas Actinids, menjadi anggota kedelapannya. Nomor atom Anda adalah 97. Itu adalah padatan logam sintetis. Elemen ini tidak ditemukan secara alami di atas kerak bumi. Ini hadir dalam jumlah kecil dalam bahan bakar nuklir bekas dan memiliki kilau perak.
Ada juga sejumlah kecil yang tersebar di lingkungan karena uji senjata nuklir, karena kecelakaan serius dalam fasilitas energi atom seperti chernobyl dan dengan pelepasan yang terjadi dari limbah dari pembangkit energi nuklir nuklir.
 Simbol, angka dan massa atom dari elemen Berkelio. Sumber: Me/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/2.5). Sumber: Wikimedia Commons.
Simbol, angka dan massa atom dari elemen Berkelio. Sumber: Me/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/2.5). Sumber: Wikimedia Commons. Utilitas praktis untuk Berkelio belum ditemukan, karena terjadi dalam jumlah yang sangat kecil dan fakta bahwa semua isotopnya (atom BK dengan jumlah neutron yang berbeda dalam nukleus) adalah radioaktif. Aplikasi utamanya adalah dalam studi ilmiah.
Meskipun isotop mereka diproduksi secara artifisial di laboratorium khusus dan ditangani oleh personel ahli, kerusakan yang dipancarkan radiasi berbahaya harus selalu diperhitungkan.
[TOC]
Tata nama
- Simbol Berkelio, BK.
- Berkelio-243, BK-243 atau 243BK: Berkelio isotop dengan massa atom 243.
Penemuan
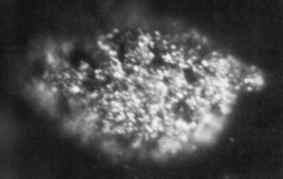 1.7 Mikrofografi Mikrogram Berkelio Logam Padat Diperoleh pada tahun 1969. Laboratorium Nasional Oak Ridge, Departemen Energi / Domain Publik AS. Sumber: Wikimedia Commons.
1.7 Mikrofografi Mikrogram Berkelio Logam Padat Diperoleh pada tahun 1969. Laboratorium Nasional Oak Ridge, Departemen Energi / Domain Publik AS. Sumber: Wikimedia Commons. Ini pertama kali diproduksi pada tahun 1949 oleh para ilmuwan Glen Seaborg, Stanley G. Thompson dan Al Ghiorso di Universitas Berkeley di California, ketika mereka membombardir amerika-241 dengan partikel alfa berenergi tinggi menggunakan cyclotron (akselerator partikel).
Segera setelah iradiasi, material dilarutkan dengan benar dan melewati kolom resin pertukaran ion, menggunakan larutan amonium sitrat sebagai eluen.
Dengan cara ini mereka memperoleh isotop elemen nomor 97 dengan 243 massa atom, yang memancarkan partikel alpha dan memiliki setengah kehidupan 4,5 jam.
Nama Elemen
Pada awalnya beberapa peneliti mengusulkan bahwa elemen tersebut mengambil nama salah satu penemu, Glen Seaborg, karena ia memiliki manfaat telah berhasil mensintesis 10 elemen dalam beberapa tahun kerja.
Dapat melayani Anda: gelas kimiaNamun, Organisasi Resmi International Union of Pure and Applied Chemistry atau IUPAC (akronim untuk bahasa Inggris Persatuan Internasional Kimia Murni dan Terapan) memutuskan untuk menugaskan nama "Berkelio" karena telah diperoleh di Universitas dan Kota Berkeley (California).
 Penampilan area Universitas Berkeley, Califronia. Penulis: Sarangib. Sumber: Pixabay.
Penampilan area Universitas Berkeley, Califronia. Penulis: Sarangib. Sumber: Pixabay. Nama Berkeley berasal dari filsuf Angloirlandés George Barkeley, nama yang pengucapannya kemudian berubah di Amerika Serikat ketika kota dan universitas didirikan pada tahun 1869.
Itu dengan santai adalah tahun di mana Dmitri Mendeléyev menerbitkan tabel periodik pertamanya dan mulai memprediksi keberadaan unsur -unsur baru seperti Berkelio.
Struktur elektronik
Konfigurasi elektroniknya adalah:
1S2; 2S2 2P6; 3S2 3P6 3D10; 4S2 4P6 4D10 4F14; 5S2 5P6 5D10; 6S2 6P6; 5F9 7S2,
atau kompak:
[Rn] 5F9 7S2.
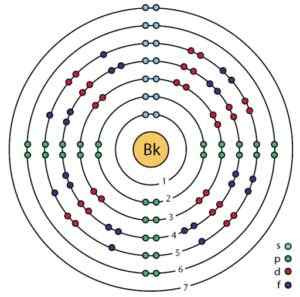 Struktur elektronik Berkelio. Orbital dan elektron dapat dilihat. Ahazard.Ilmu Ilmu Pengetahuan/CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Struktur elektronik Berkelio. Orbital dan elektron dapat dilihat. Ahazard.Ilmu Ilmu Pengetahuan/CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Memperoleh
Sampel pertama logam disiapkan pada tahun 1969 melalui reaksi reduksi fluoride (BKF3) Dengan logam lithium (Li) pada suhu 1300 K.
Untuk menyiapkan lembaran logam tipis, bko oksida berkurang2 Dengan torio (th) atau logam lantano.
Sifat fisik Berkelio
Keadaan fisik
Solid logam yang diserap.
Logam Berkelio memiliki dua bentuk kristal: alpha (segi enam kompak ganda) dan beta (kubik berpusat pada wajah).
Massa atom
247
Titik lebur
1050 ºC (bentuk alfa)
986 ° C (bentuk beta)
Titik didih
2627 ºC
Kepadatan
14.78 g/cm3 (Formulir Alpha)
13.25 g/cm3 (formulir beta)
Paramagnetisme
Menurut beberapa sumber senyawa Berkelio tertentu menunjukkan sifat paramagnetik, yang berarti mereka tertarik pada medan magnet.
Karakteristik ini adalah tipe paramagnetik karena saat menangguhkan aksi magnetik, bahan gagal mempertahankan sifat tersebut saja.
Sifat kimia
Pada suhu tinggi, Berkelio logam dengan cepat teroksidasi di udara atau oksigen, membentuk oksida. Itu mudah larut dalam asam mineral, melepaskan gas hidrogen h2 dan membentuk ion BK3+.
Dapat melayani Anda: aluminium hydride (ALH3): Struktur, sifat, penggunaanKeadaan oksidasi
Investigasi awal elemen ini terbatas pada pertukaran ion dan percobaan copresipitasi, yang dengannya diamati bahwa keadaan oksidasi +3 stabil dan +4 dapat diakses dalam larutan air, karena BK3+ Itu dapat dioksidasi oleh ion bromat (bro4-) Untuk memberi bk4+.
Stabilisasi BK4+
Pada 2017 stabilisasi BK dilaporkan4+ Dalam larutan menggunakan senyawa yang dibentuk oleh kelompok hidroksipiridinon yang disatukan dengan struktur poliamina (disebut ligan 3,4,3-Li (1,2-hop))).
Senyawa ini memiliki delapan tempat di mana ion bergabung, yang sesuai dengan atom oksigen kelompok C = O dan N-OH, meninggalkan BK4+ terkait kuat dengan ligan, tetap stabil.
Senyawa padat
Bk4+ dapat coprecipitate dengan Cerio (CE4+) atau zirkonium (zr4+) dalam fosfat atau yodato. Ini juga dapat diekstraksi dalam larutan heksana bis (2-etilheksil) hidrogenofosfat atau agen akomodatif serupa lainnya.
Senyawa Berkelio pertama yang terjadi dalam jumlah yang terlihat adalah klorida (BKCL3), dari mana 0,000000003 gram diperoleh pada tahun 1962. Sejak itu beberapa senyawa Berkelio telah dapat mempersiapkan dan belajar.
Mereka dapat disebutkan misalnya fosfat (BKPO4), oksychloride (bkocl), fluorida (bkf3 dan bkf4), Dioksida (BKO2), trioksida (bk2SALAH SATU3), Yodatos (bk (IO3)3 dan bk (io3)4), Chlorohydrate [bkcl2(H2SALAH SATU)6] CL, oksalat, senyawa organomethalic dan senyawa koordinasi, antara lain.
Keadaan oksidasi baru +5
Pada tahun 2018 sekelompok peneliti dari beberapa negara berhasil menghasilkan kompleks nitrat dengan pentavalent berkelio (bk5+) Formulanya BKO2(TIDAK3)2-, dengan menghilangkan dua molekul tanpa2 ion bk (tidak3)4-, (Bk3+).
Perhitungan energi komputasi mengkonfirmasi bahwa keadaan oksidasi +5 adalah yang memiliki stabilitas terbesar dalam kompleks nitrat Berkenilo ini, oleh karena itu yang paling mungkin terjadi.
Isotop
Dari Berkelio, 14 isotop dengan massa atom telah disintesis dari 238 hingga 251. Semuanya radioaktif.
Ini dapat melayani Anda: Benchilo: Benzyl Hydogen, Karbokations, Benzyl RadicalsYang paling stabil adalah Berkelio-247, yang paruhnya adalah 1380 tahun. Setiap atom isotop ini saat disintegrasi memancarkan partikel alfa dan membentuk atom Amerika-243.
BK-249 memiliki waktu paruh 330 hari, menderita beta pembusukan dan menjadi californio-249.
Aplikasi
Karena mereka hanya dapat memperoleh sejumlah kecil elemen ini, ia hanya digunakan dalam penelitian ilmiah dasar.
Dalam memperoleh elemen yang lebih berat
Isotop BK-249 memiliki waktu paruh yang relatif panjang dan mungkin.
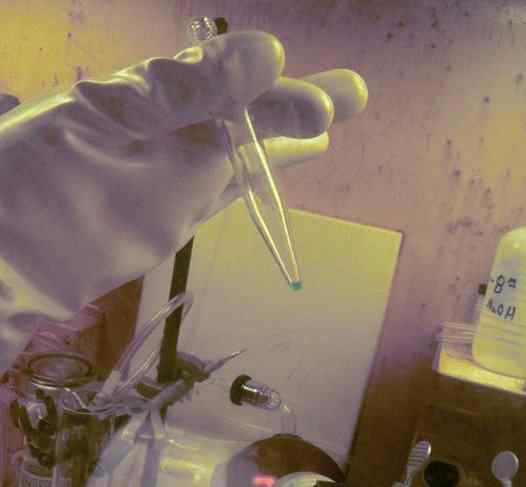 BK Mikrokantitas dilarutkan dalam tabung reaksi. 250 hari digunakan untuk mendapatkannya. Sarung tangan perlindungan radioaktivitas dari elemen ini dapat diamati. ORNL, Departemen Energi / Domain Publik. Sumber: Wikimedia Commons.
BK Mikrokantitas dilarutkan dalam tabung reaksi. 250 hari digunakan untuk mendapatkannya. Sarung tangan perlindungan radioaktivitas dari elemen ini dapat diamati. ORNL, Departemen Energi / Domain Publik. Sumber: Wikimedia Commons. Dalam studi fisikokimia
Penelitian yang dilakukan dengan BK memungkinkan ekstrapolasi yang lebih tepat tentang sifat dan perilaku elemen lain yang mengikuti dalam seri akting, karena elemen terberat lebih sulit diperoleh, mereka memiliki kehidupan rata -rata yang sangat pendek dan jauh lebih radioaktif.
Risiko
Berkelio adalah elemen radioaktif. Pelepasan radioaktivitas di lingkungan dapat menjangkau semua spesies hewan dan tumbuhan yang menyebabkan kerusakan pada mereka. Kerusakan dapat menumpuk dalam generasi yang berurutan.
 Pabrik energi nuklir bersifat radioaktif dan karenanya sangat berbahaya. Penulis: AR130405. Sumber: Pixabay.
Pabrik energi nuklir bersifat radioaktif dan karenanya sangat berbahaya. Penulis: AR130405. Sumber: Pixabay. Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Berkelium - BK (Elemen). Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Putih, f.D. et al. (2019). Kimia Kontemporer Berkelium dan Californium. Kimia 2019 6 Agustus; 25 (44): 10251-10261. Pulih dari PubMed.NCBI.Nlm.Nih.Pemerintah.
- Timah, d.R. (Editor) (2003). Buku Pegangan Kimia dan Fisika CRC. 85th CRC Press.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Kelley, m.P. et al. (2018). Bond Covalecy dan oksidasi keadaan aktinida INS kompleks dengan agen chelating terapeutik 3,4,3-LI (1,2-hopo). Inorg. Chem. 7 Mei 2018; 57 (9): 5352-5363. Pulih dari PubMed.NCBI.Nlm.Nih.Pemerintah.
- Kovács, a. et al. (2018). Pentavalent Curium, Berkelium, dan Californium di Nitrate Complex: Memperluas Kimia Aktinida dan Negara Oksidasi. Chem. 2018 6 Agustus; 57 (15): 9453-9467. Pulih dari PubMed.NCBI.Nlm.Nih.Pemerintah.
- Orlova, a.yo. (2007). Kimia dan Kimia Struktural Orthoffers Tri-Totravalent Actinide Anhidrat. Dalam Kimia Struktural Senyawa Aktinida Anorganik. Pulih dari scientedirect.com.
- Choppin, g. et al. (2013). Elemen aktinida dan transaktinida. Dalam Radiekimia dan Kimia Nuklir (Edisi Keempat). Pulih dari scientedirect.com.
- Peterson, J.R. dan Hobart, D.DAN. (1984). Kimia Berkelium. Kemajuan Kimia Anorganik, Volume 28, 1984, Halaman 29-72. Pulih dari scientedirect.com.
- Royal Society of Chemistry. (2020). Berkelium. RSC pulih.org.

