Struktur natrium borohydride (nabh4), sifat, penggunaan

- 4539
- 2
- Pete Lesch
Dia Sodium Boron Itu adalah padatan anorganik yang formula kimianya nabh4. Dapat dianggap mewakili borohidruro alkali dan merupakan yang paling umum dari ini. Itu adalah padatan putih kristal.
Atas kontak dengan air, nabh4 dapat menghasilkan panas dan hidrogen h2 yang merupakan bahan bakar, jadi harus ditangani dengan hati -hati. Untuk kemudahan yang dapat menghasilkan ion hidrida h-, Sodium Boron adalah senyawa pereduksi sedang, sehingga banyak digunakan dalam reaksi kimia untuk tujuan ini.
 Sodium borohydride, nabh4, padat. Ondřej Mangl [domain publik]. Sumber: Wikimedia Commons.
Sodium borohydride, nabh4, padat. Ondřej Mangl [domain publik]. Sumber: Wikimedia Commons. Properti reduksi juga digunakan dalam industri kertas, karena memungkinkan untuk meningkatkan karakteristik kecerahan dan stabilitas pulpa dan kertas saat bertindak terhadap oksidasi selulosa, komponen utama kertas ini.
Karena dengan adanya air dapat dengan mudah membentuk hidrogen, kemungkinan menggunakannya sebagai sumber hidrogen reversibel dalam sel bahan bakar juga telah diselidiki.
Ini memiliki penggunaan lain semua berdasarkan properti pereduksi, seperti di industri farmasi.
[TOC]
Struktur
Sodium Boron adalah senyawa ionik. Itu dibentuk oleh anion borohidrida [bh4]- bersama dengan na kation natrium+.
Anion [bh4]- Itu tetrahedral.
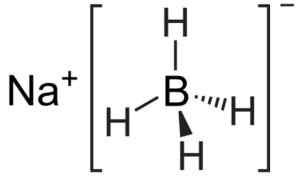 Struktur natrium borohidrida. Kemikungen [domain publik]. Sumber: Wikimedia Commons.
Struktur natrium borohidrida. Kemikungen [domain publik]. Sumber: Wikimedia Commons. Struktur Lewis -nya adalah sebagai berikut:
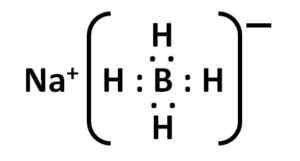 Struktur elektronik Nabh Lewis4. Penulis: Marilú Stea.
Struktur elektronik Nabh Lewis4. Penulis: Marilú Stea. Tata nama
-Sodium Boron
-Sodium tetrahydroate
-Sodium tetrahydrurorat
Properti fisik
Keadaan fisik
Solid putih kristal.
Berat molekul
37.84 g/mol
Suhu self -rection
∼ 220 ºC
Suhu dekomposisi
> 250 ºC
Kepadatan
1.074 g/cm3 pada 20 ºC
Dapat melayani Anda: reagen grignard: persiapan, aplikasi, contohKelarutan
Nabh4 Cukup larut dalam air (55 g/100ml pada 25 ° C), di mana sebagian dihidrolisis. Itu larut dalam tetrahydrofurano (THF) dan tidak larut dalam dietyl eter.
Sifat kimia
Sodium boron dilarutkan dalam air, di mana ia menderita dekomposisi atau hidrolisis awal yang membuat larutan dasar, yang mencegah hidrolisis berikutnya.
[BH4]- + H2O → B (OH)3 + H2↑ + oh-
Ini dijelaskan karena [bh4]- berinteraksi dengan h+ Air, di mana h+ Ambil Hydride H Anion- Untuk membentuk h2. Dapat dikatakan bahwa bh3 bersaing dengan h+ Untuk hidrida h-.
Dalam hidrolisis medium asam selesai karena kelimpahan ion H+.
Nabh4 Itu stabil di udara kering. Itu tidak mudah berubah.
Karena kandungan ion hidrida, natrium boron adalah senyawa pereduksi. Ini memungkinkan untuk mengurangi kelompok karbonil C = o a c-oh, yaitu senyawa karbonil menjadi alkohol.
Nabh4 Dengan sendirinya tidak mengurangi ikatan rangkap C = C, bahkan konjugat dengan grup karbonil -c = c -c (= O)-.
Namun, saat bersentuhan dengan asam protonat (seperti HCl) atau asam Lewis (seperti Bcl3 atau alcl3) Diborano b terbentuk2H6. Dan jika reaksi ini dilakukan dengan adanya senyawa organik dengan ikatan rangkap c = c Diborano b2H6 Melakukan hidrobacion dari ini.
Di hadapan katalis yang sesuai dan kondisi spesifik natrium boron dapat mengurangi berbagai jenis kelompok fungsional.
Risiko
Panas reaksi hidrolisis dalam air sudah cukup untuk menghidupkan hidrogen yang terbentuk di dalamnya. Jadi penting untuk berhati -hati saat memanipulasinya.
Nabh4 Itu mudah dan mudah dibakar.
Memperoleh
Reaksi persiapan nabh yang khas4 Itu melalui natrium hidrida nah dan b (och3)3 pada suhu sekitar 250 ºC:
Itu bisa melayani Anda: elektrolisis air4 Nah + B (OCH3)3 → Nabh4 + 3 Naoch3
Aplikasi
Dalam reaksi kimia pengurangan
Karena menjadi sumber hones h-, Nabh4 Ini adalah senyawa pereduksi dan digunakan untuk menyiapkan senyawa kimia lainnya. Untuk melakukan ini, ini digunakan dalam pelarut polar apratotic, yaitu, tanpa proton H+, seperti dimethylsulfoxide, hexamethylphosphoror dan dimethyloformamide.
Ini digunakan sebagai agen pereduksi dalam reaksi kimia organik dan anorganik.
Ini memungkinkan untuk mengurangi aldehida menjadi alkohol dan keton primer menjadi alkohol sekunder.
Ini juga mengurangi alkil halida menjadi hidrokarbon seperti iododan menjadi dekan.
Jika bertindak sendiri, saat melakukan reduksi tidak mempengaruhi gugus fungsional lain seperti ester, asam karboksilat, nitril dan sulfon.
Propertinya tidak mengurangi ikatan rangkap C = C, bahkan konjugat dengan grup karbonil -c = c-c (= o)-, memungkinkan Anda untuk menyiapkan alkohol tak jenuh -c = c-ch2-Oh.
Untuk mengurangi senyawa aromatik nitrado ke anilin yang sesuai membutuhkan adanya katalis seperti kobalt klorida atau timah. Kurangi disulfida ke tiol.
Di hadapan kondisi dan katalis yang sesuai, ia memungkinkan untuk mengurangi asam karboksilat, ester, di tengah -tengah, nitril, imine, epoksida dan bahkan ikatan ganda dan tiga.
Dalam h2 Dalam sel bahan bakar
Nabh4 Itu bisa diubah menjadi sel bahan bakar.
Nabh4 Di hadapan larutan alkali KOH atau NaOH dihidrolisis dan menghasilkan hidrogen H2 yang dapat digunakan sebagai bahan bakar dalam baterai bahan bakar elektrolit polimer.
Itu juga telah diselidiki sebagai bahan h untuk penyimpanan h dari h2 secara terbalik.
Nanopartikel nabh disintesis4 dan stabil dengan surfaktan. Setelah perawatan dengan NICL2 Lapisan atau lapisan pelindung terbentuk yang mengatur pelepasan h2 sepenuhnya terbalik.
Itu dapat melayani Anda: perak nitrat (agno3): struktur, sifat, penggunaan, toksisitasBahan nanometrik baru ini akan memungkinkan penggunaan h2 sebagai bahan bakar yang bersih dan terbarukan diproduksi.
 Kendaraan yang bekerja dengan sel bahan bakar hidrogen. Kata. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Kendaraan yang bekerja dengan sel bahan bakar hidrogen. Kata. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Di industri pulp dan kertas
Sodium Boron digunakan untuk meningkatkan kecerahan dan sifat fisik pulpa dan kertas lainnya.
Degradasi matriks selulosa kertas terjadi melalui proses kompleks yang melibatkan oksidasi. Kelompok hidroksil mengoksidasi karbonil dan karboksil, ini menyebabkan perubahan warna kertas dan penurunan sifat fisik.
Saat merawat pulp atau kertas dengan nabh4, Ini mengurangi aldehida dan keton menjadi kelompok -OH tanpa mempengaruhi gugus karboksilat asam, meningkatkan stabilitas dan kecerahan terhadap nilai yang lebih besar dari inisial.
 Nabh4 memungkinkan untuk meningkatkan kecerahan kertas. Penulis: Rawpixel. Sumber: Pixabay.
Nabh4 memungkinkan untuk meningkatkan kecerahan kertas. Penulis: Rawpixel. Sumber: Pixabay. Dalam beberapa kegunaan
Sodium Boron digunakan untuk mengolah air limbah, sebagai agen rasa yang tidak tepat dalam industri makanan dan minuman, sebagai agen pelapis dan untuk perawatan permukaan, dalam produksi tembakau, dalam farmasi, tekstil dan kulit industri tekstil.
Referensi
- Christian, m.L. dan ortuey-zinsou, k.-F. (2012). Strategi core-shell yang mengarah ke kapasitas penyimpanan hidrogen reversibel tinggi untuk nabh4. ACS Nano 2012, 6, 9, 7739-7751. Pulih dari pub.ACS.org.
- Nora de Souza, m.V. dan Alves v., T.R. (2006). Metodologi terbaru yang dimediasi oleh natrium borohidrida dalam pengurangan kelas senyawa yang berbeda. Aplikasi. Organometal. Chem. 2006; 20: 798-810. Diperoleh dari perpustakaan online.Wiley.com.
- Imamoto, t. (1991). Pengurangan. Sodium borohydride. Dalam memahami sintesis organik. Pulih dari scientedirect.com.
- Tang, l.C. (1986) Stabilisasi kertas melalui pengobatan natrium borohidrida. Dalam bahan tekstil dan kertas bersejarah. Bab 24. Halaman 427-441. Kemajuan dalam Kimia, Volume 212. Pulih dari pub.ACS.org.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Morrison, Robert Thornton; dan Boyd, Robert Neilson. 1992. Kimia organik. Prentice-Hall. ISBN 81-203-0765-8.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Sodium borohydride. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah.

