Sejarah Borax, Struktur, Properti, Penggunaan, Sintesis, Risiko

- 2024
- 27
- Ernesto Mueller
Dia Boraks atau natrium borat Ini adalah denominasi untuk sekelompok senyawa kimia dengan formula dasar Na2B4SALAH SATU7. Ini adalah garam higroskopis yang mampu membentuk banyak hidrat, selain memperkaya secara struktural dengan adanya pengotor logam tertentu.
Senyawa utama yang disebut Borax adalah sebagai berikut: Anhydro Sodium Tetraborate, NA2B4SALAH SATU7; Pentahydrate Sodium Tetraborate (NA2B4SALAH SATU7).5H2SALAH SATU; dan natrium tetraborate, na2B4SALAH SATU7.10h2Atau, atau setara, natrium tetraborat oktahidrat, na2B4SALAH SATU5(OH)4.8h2SALAH SATU.
 Fragmen boraks. Sumber: Leon Hupperichs [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Fragmen boraks. Sumber: Leon Hupperichs [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Seperti yang dapat dilihat, semua padatan sebelumnya hanya berbeda dalam tingkat hidrasi mereka; Beberapa memiliki lebih banyak molekul air dalam kristal mereka daripada yang lain. Boraks fisik mirip dengan potongan atau kristal kapur yang kuat (gambar superior).
Secara alami, boraks ditemukan dalam sedimen danau musiman, dikeringkan dengan penguapan. Borax terjadi di Turki, danau Searles (California), di Atacama, Chili, Bolivia, Tibet, dan Gurun Rumania. Secara sintetis, kristal boraks dapat diperoleh melalui proses nukleasi yang lambat; yaitu, di mana pertumbuhan kristal disukai.
Tetraborate natrium, anhidrat dan dekayidrasi sedikit larut dalam air dingin; tetapi kelarutannya meningkat dengan peningkatan suhu. Na2B4SALAH SATU7.10h2Atau sangat larut dalam etilen glikol, cukup larut dalam etanol dan sedikit larut dalam aseton; Ini lebih sedikit pelarut kutub daripada air.
Borax memiliki banyak aplikasi, seperti dalam elaborasi deterjen dan sabun; sebagai penundaan api bahan selulosa; dalam produksi fiberglass; dalam pembersihan permukaan keras seperti logam, kaca dan keramik; dan dalam penghambatan korosi, di antara penggunaan lainnya.
Borax mengiritasi mata, kulit, dan saluran pernapasan. Dengan konsumsi dapat menghasilkan, di antara gejala -gejala lainnya, muntah, diare, kendur, pembusukan dan kejang dan kejang. Saat ini diduga bahwa efek berbahaya pada reproduksi manusia dapat dimiliki.
[TOC]
Sejarah
Sejarah Borax membingungkan. Ditunjukkan bahwa itu ditemukan di tempat tidur danau Tibet, dikeringkan dengan penguapan. Itu dipindahkan pada abad ketujuh Tibet ke Arab Saudi, mengikuti rute sutra yang disebut SO.
Istilah "Borax" sangat populer mengikuti banyak aplikasi yang ditemukan dan dipasarkan dengan nama 20 Mule Team Borax Tradermax, yang merujuk pada cara Borax diangkut melalui gurun Nevada dan California.
Versi lain dari penemuan mereka menunjukkan bahwa orang Mesir sudah lama dikenal karena keberadaannya, menggunakannya di lasan logam oleh panas. Selain itu, mereka menggunakannya dalam kedokteran dan dalam proses mumifikasi. Borax dipindahkan ke Eropa pada abad ketiga belas oleh Marco Polo.
Pada pertengahan abad ke -19, endapan boraks besar ditemukan di gurun Magove, yang membuat penggunaannya umum sejak itu.
Struktur boraks
 Struktur ion boraks. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Struktur ion boraks. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Gambar superior menunjukkan ion yang membentuk boraks, secara khusus sesuai dengan padatan dengan rumus komposisi Na2[B4SALAH SATU5(OH)4] · 8h2Atau (atau na2B4SALAH SATU7· 10h2SALAH SATU).
Pertama, struktur anion yang dikurung dapat diperhatikan [b4SALAH SATU5(OH)4]2- (Meskipun saya harus memiliki dua kelompok-), di mana cincin segi delapan (empat atom B dan empat O) dapat dilihat), dengan jembatan B-O-B yang membaginya menjadi dua bagian.
Dapat melayani Anda: Solusi Alkali: Definisi, Properti dan PenggunaanKandang ini tidak tetap statis, tetapi bergetar dan mengadopsi konformasi yang berbeda dalam ruang; Namun, pada tingkat yang lebih rendah di sekitar jembatan. Dapat juga diperhatikan bahwa itu sangat "teroksigenasi"; Artinya, ia memiliki banyak atom oksigen, yang mampu berinteraksi dengan molekul air menggunakan jembatan hidrogen.
Tidak mengherankan bahwa kristal boraks dapat melembabkan dan menghasilkan banyak hidrat. Jadi, untuk na padat2[B4SALAH SATU5(OH)4] · 8h2Atau, ada delapan molekul H2Atau berinteraksi dengan kandang borarat, dan pada saat yang sama, dengan pusat logam NA+.
Di sisi kation, Anda memiliki kompleks berair [NA (h2SALAH SATU)4]+N, di mana nilai n akan tergantung pada proporsi anion/kation. Di padatan atas, n = 2, jadi Anda memiliki: [na2(H2SALAH SATU)8]2+, yang bebannya 2+ menetralkan beban 2- dari anion borarate.
Kristal
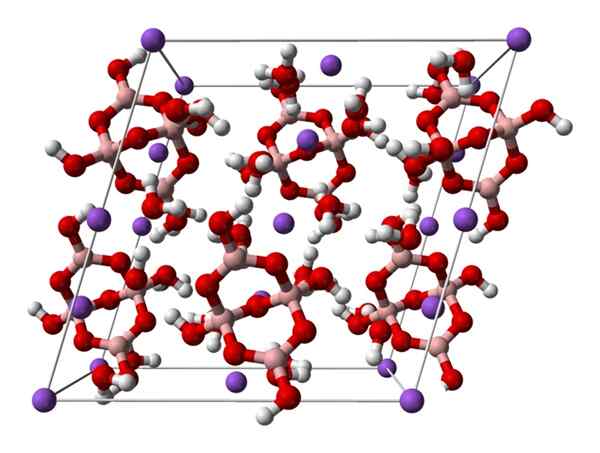 Sel monoklinik boraks. Sumber: Ben Mills [Publik
Sel monoklinik boraks. Sumber: Ben Mills [PublikDomain].
Ke atas2[B4SALAH SATU5(OH)4] · 8h2Atau atau na2B4SALAH SATU7· 10h2SALAH SATU. Di sini atraksi elektrostatik dan jembatan hidrogen mengatur atau mendominasi pola struktural yang berasal dari setiap kaca kaca.
Hidrat lain dan garam anhidrat kehilangan satu atau semua molekul airnya, mengubah komposisi dan struktur kristal boraks. Dalam semua itu, anion dan kation tetap sama (kecuali ada pengotor atau reaksi lateral), sehingga kebingungan tidak dapat dihasilkan.
Kebingungan dengan anion boraato
Na2[B4SALAH SATU5(OH)4] · 8h2Atau dan na2B4SALAH SATU7· 10h2Atau mereka sama. Karena?
Pertama, jika atom mereka dihitung, mereka akan melihat bahwa mereka bertepatan dalam jumlah; Dan kedua, dalam anion b4SALAH SATU72- Tidak adanya dua kelompok OH yang terkait dengan kepala boron dari jembatan B-O-B dipertimbangkan; dua oh itu, bersama dengan keduanya+ dari b4SALAH SATU72-, Tambahkan hingga 2 jam2Atau, memberikan total 10 jam2O (8 + 2).
Properti
Nama
- Boraks.
- Sodium borarate.
- Sodium Tetraborate.
- Tetraborate yang dapat ditarik.
Massa molekul
Anhydro: 201,22 g/mol.
Decohydrate: 381.38 g/mol.
Penampilan fisik
Padatan putih kristal.
Kepadatan
Anhydrous: 2,4 g/cm3
Decahixture: 1.739 g/cm3
Titik lebur
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decohydrate: 75 ºC.
Titik didih
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
Kelarutan air
31,78 g/l (keduanya untuk anhidrat dan dekayroper).
Kelarutan dalam pelarut organik
Ini sangat larut dalam etilen glikol, cukup larut dalam dietilen glikol dan metanol, dan sedikit larut dalam aseton.
Indeks refraksi (ηd)
Anhidro: η1 = 1.447; η2 = 1.469.
Decayedrado: η2 = 1.472.
Stabilitas
Itu stabil dalam kondisi penyimpanan yang memadai. Meskipun memiliki tekanan uap yang rendah, meningkat dengan suhu, menyebabkan kristalisasi dan kondensasi, sehingga suhu yang berlebihan dan fluktuasi kelembaban harus dihindari.
Emisi ringan
Natrium tetraborate saat mengalami aksi api memancarkan lampu hijau.
Reaksi
- Saat larut dalam air, larutan alkali berasal dengan pH sekitar 9.2.
- Borax bereaksi untuk membentuk borat lain, seperti Perborate (PBS).
- Ini juga menghasilkan asam borat saat bereaksi dengan asam klorida:
Na2B4SALAH SATU7· 10h2O + hcl => 4 jam3Bo3 + 2 na+ + 2 Cl- + 5 jam2SALAH SATU
- Sodium tetraborate berperilaku sebagai zat amphohete, karena dalam larutan berair dihidrolisis dan mampu menetralkan asam. Dengan cara yang sama, ia mampu menetralkan alkali konsentrasi tinggi, menghindari ketinggian pH medium yang berlebihan.
Dapat melayani Anda: alkohol primer: struktur, sifat, nomenklatur, contohAplikasi
Borax memiliki banyak aplikasi, baik dalam diri manusia maupun dalam serangkaian kegiatan yang dilakukannya.
Tindakan antioksidan
Borax memiliki kemampuan untuk melarutkan oksida. Untuk alasan ini digunakan dalam pemulihan logam seperti kuningan, tembaga, timbal dan seng.
Ini juga digunakan untuk mencegah oksidasi batang logam di fondasi. Boraks menutupi permukaannya, tidak termasuk udara, dan karenanya, menghindari oksidasi. Selain itu, itu mencegah korosi bahan besi dalam pembuatan mobil.
Kelarutan Boraks dalam Ethylene Glycol telah berguna dalam formulasi antibeku. Borax menetralkan limbah asam yang diproduksi selama dekomposisi etilen glikol, meminimalkan oksidasi yang dapat diderita permukaan logam.
Elaborasi perekat
- Borax adalah bagian dari formulasi pati perekat untuk kertas dan kardus bergelombang.
- Ini adalah agen peptisasi dalam pembuatan perekat berdasarkan kasein dan dekstrin.
- Tindakan memperkuat bahan perekat dengan melintasi kelompok hidroksil terkonjugasi.
Retardant Api
Ini digunakan sebagai penghambat api dalam bahan selulosa dan polimer lain yang mengandung kelompok hidroksi. Itu mengerahkan aksinya melalui beberapa mekanisme, termasuk pembentukan lapisan vitreous yang membatasi akses bahan bakar.
Elaborasi Kaca Borosilisasi (Pyrex)
Borax adalah sumber boron yang digunakan dalam elaborasi kaca borosilisasi; ditandai dengan titik fusi yang tinggi, koefisien ekspansi rendah dan resistensi tinggi terhadap guncangan termal.
Ini memungkinkan Anda mengalami suhu tinggi tanpa mengalami patah tulang, menerima denominasi kaca refraktori.
Kaca borosilisasi digunakan dalam elaborasi bahan untuk digunakan di rumah untuk memanggang makanan. Ini juga digunakan di laboratorium di gelas kimia, fixola, silinder pengukuran, pipet, dll.
Emulsifier
Borax, bersama dengan senyawa lain, digunakan untuk mengemulsi sabun dan parafin lainnya. Ini juga digunakan sebagai dasar untuk elaborasi lotion, krim, dan salep.
Bahan pembersih
- Ditambahkan dalam formulasi untuk membersihkan permukaan yang kuat seperti logam, kaca dan keramik.
- Ini digunakan dalam pembersih tangan, bahan pemolesan dan sabun deterjen di binatu dan rumah. Selain itu, ia memfasilitasi penghapusan deposit berminyak dari lantai pabrik.
Penggunaan medis
- Ini digunakan dalam pengobatan infeksi jamur kaki.
- Itu adalah bagian dari formula nutrisi yang memasok boron. Elemen ini dianggap campur tangan dalam metabolisme kalsium, fosfor dan magnesium, yang diperlukan untuk struktur tulang.
- Ini mengintervensi dalam penentuan hemoglobin glikosilasi (HbA1c), bukti yang berfungsi untuk mengetahui perkembangan diabetes jangka panjang pada pasien, karena waktu setengah kehidupan eritrosit adalah 120 hari adalah 120 hari adalah 120 hari.
Informasi ini lebih berguna bagi dokter daripada penentuan terisolasi glukosa darah pasien.
PH Shock Absorber
Ini digunakan dalam beberapa peredam kejut pH yang digunakan dalam biokimia; Di antara mereka, Tris (hidroksimetil) aminometana-boray, digunakan dalam elektroforesis dalam poliakrilamida asam nukleat DNA dan RNA.
Penurunan kekerasan air
Borax mampu menggabungkan dengan ion kalsium dan magnesium yang ada di dalam air, mengurangi konsentrasinya. Dengan cara ini kekerasan air berkurang.
Dapat melayani Anda: kalium hidroksida: struktur, sifat, penggunaanPupuk dan pupuk
Borax digunakan sebagai sumber boron. Kalsium dan boron terlibat dalam pembentukan dinding sel tanaman. Selain itu, telah ditunjukkan bahwa boron mendukung penyerbukan, sehingga mengintervensi pembuahan dan proliferasi tanaman.
Konservasi kayu
Borax bertarung melawan Woodwood, kumbang yang mengkonsumsi dan menghancurkan kayu. Ini juga digunakan dalam konservasi dan pemeliharaan kapal kayu.
Pendirian dan aliran
Ini digunakan sebagai pendiri dalam pengelasan baja dan besi, menyebabkan penurunan titik leleh dan eliminasi besi oksida; Polutan yang tidak diinginkan. Dengan tujuan yang sama, ia berpartisipasi dalam pengelasan emas dan perak.
Yang lain
- Ini digunakan sebagai pestisida lembut; Misalnya, untuk pertempuran ngengat dalam wol.
- Disemprotkan untuk mengendalikan hama yang ada di lemari, endapan internal, di celah dinding, dan secara umum, di mana penggunaan pestisida yang lebih berpolusi tidak diinginkan.
- Ini digunakan dalam reaktor nuklir untuk mengontrol reaksi yang dapat menghasilkan, dalam kasus ekstrem, reaksi berantai.
- Di Radiator Mobil, Borax digunakan untuk mendapatkan situs di mana ada pelarian air.
Perpaduan
Borax diperoleh dengan bereaksi5SALAH SATU9.8h2Atau, dengan natrium karbonat dan natrium hidrokarbonat dalam media berair.
Sebenarnya, sintesis natrium atau tetraborat boraks hanya digunakan sedikit; Sebagian besar senyawa yang dihasilkan diperoleh dengan ekstraksi mineral yang mengandungnya.
Proses dapat dirangkum dalam larutan bijih dalam air, diikuti oleh filtrasi tanah liat dan akhirnya penguapan dari larutan berair.
Risiko
Borax adalah produk alami, namun, dapat menghasilkan serangkaian kerusakan kesehatan pada manusia. Misalnya, karena kontak dengan debu debu, iritasi pada kulit yang dapat menyebabkan dermatitis dapat terjadi.
Demikian juga, Borax menghasilkan iritasi mata dan saluran pernapasan atas. Di antara gejala inhalasinya, ada sakit batuk dan tenggorokan.
Sementara itu, asupan boraks menyajikan gejala berikut: muntah, mual, diare, kendur, sakit kepala dan kejang dan kejang. Selain itu, pengaruh sistem saraf pusat dan fungsi ginjal dapat terjadi.
Dari penelitian yang dilakukan pada tikus jantan -sex, diumpankan dengan boraks, atrofi testis diamati. Sementara penelitian yang dilakukan dengan tikus betina hamil menunjukkan bahwa boraks dapat melintasi plasenta, menghasilkan perubahan perkembangan janin, dimanifestasikan oleh berat lahir rendah.
Dipercayai bahwa paparan boraks dapat mempengaruhi fungsi reproduksi pria pada manusia, dimanifestasikan oleh pengurangan penghitungan sperma.
Dosis fatal 10 hingga 25 gram diperkirakan untuk asupan boraks pada orang dewasa.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Pusat Nasional Informasi Bioteknologi. (2019). Argon. Database pubchem. CID = 23968. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Karolyn Burns, Seneca Joseph, & Dr. Ryan Baumbach. (S.F.). Sintesis dan sifat kristal boraks dan paduan intermetalllic. Pulih dari: nationalmaglab.org
- Wikipedia. (2019). Boraks. Diperoleh dari: di.Wikipedia.org
- Rio Tinto. (2019). Borax Dehydrate. 20 Borax Tim Mule. Pulih dari: borax.com
- Fletcher Jenna. (14 Januari 2019). Apakah borax aman untuk digunakan? Pulih dari: MedicalNewstody.com
- « Struktur Chrome Chloride (CRCL3), Properti, Penggunaan
- Karakteristik makanan transgenik, keunggulan, contoh, konsekuensi »

