Struktur Chrome Chloride (CRCL3), Properti, Penggunaan

- 1084
- 41
- Miss Marion Graham
Dia Chrome Chloride (CRCL3) Ini adalah garam anorganik yang terdiri dari kation Cr3+ dan anion CL- dalam proporsi 1: 3; yaitu, untuk setiap CR3+ Ada tiga CL-. Seperti yang akan dilihat nanti, interaksinya bukan ionik. Garam ini dapat terjadi dalam dua bentuk: anhidra dan heksahidrat.
Bentuk anhydrous ditandai dengan menghadirkan warna ungu-reddish; Sedangkan hexahidrat, crcl3.6h2Atau, berwarna hijau gelap. Penggabungan molekul air memodifikasi sifat fisik kristal -kristal ini; sebagai titik mendidih dan fusi, kepadatan, dll.
 Kristal Violet-River dari Chrome Chloride (III) Anhydrous. Sumber: Ben Mills [domain publik]
Kristal Violet-River dari Chrome Chloride (III) Anhydrous. Sumber: Ben Mills [domain publik] Chrome chloride (III) (menurut nomenklatur stok) terurai pada suhu tinggi, menjadi krom klorida (II), CRCL2. Ini korosif untuk logam, meskipun digunakan dalam prosedur Chrome: di mana logam ditutupi dengan lapisan krom tipis.
Cr3+, Berasal dari klorida masing -masing, telah digunakan dalam pengobatan diabetes, terutama pada pasien dengan nutrisi parenteral total (TPN), yang tidak menelan jumlah krom yang dibutuhkan. Namun, hasilnya jauh lebih baik (dan lebih dapat diandalkan) jika disediakan sebagai picolinato.
[TOC]
Struktur Chrome Chloride
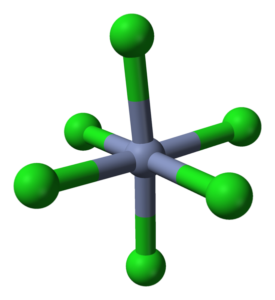 Koordinasi octaedro untuk crcl3 dalam kristal. Sumber: Ben Mills [domain publik]
Koordinasi octaedro untuk crcl3 dalam kristal. Sumber: Ben Mills [domain publik] CRCL3 Meskipun menjadi garam, sifat interaksi mereka tidak murni ionik; Mereka memiliki karakter kovalen tertentu, produk dari koordinasi antara CR3+ dan Cl-, yang memunculkan octahedron yang cacat (gambar superior). Chrome terletak di tengah octaedro, dan kloros pada simpulnya.
Octahedron crcl6 Anda dapat, pada pandangan pertama, bertentangan dengan formula CRCL3; Namun, octahedron lengkap ini tidak menentukan sel satuan gelas, tetapi kubus (juga cacat), yang memotong bola hijau atau anion klorin menjadi dua.
Dapat melayani Anda: 20 contoh sublimasi dan karakteristik kimiaLapisan kristal anhidrat
Dengan demikian, sel kesatuan dengan octaedro ini terus mempertahankan proporsi 1: 3. Mereproduksi kubus cacat ini di ruang angkasa, kristal CRCL diperoleh3, yang diwakili dalam gambar superior dengan model pengisian tiga dimensi, dan model bola dan batang.
 Lapisan Struktur Kristal CRCL3 diwakili dengan model bola dan batang tiga dimensi. Sumber: Ben Mills [domain publik]
Lapisan Struktur Kristal CRCL3 diwakili dengan model bola dan batang tiga dimensi. Sumber: Ben Mills [domain publik] Lapisan kristal ini adalah salah satu dari banyak yang membuat3 (Jangan membingungkan warna kaca, benar, dengan bola hijau).
Seperti yang bisa dilihat, anion CL- Mereka menempati permukaan, sehingga beban negatif mereka mengusir lapisan kristal lainnya. Akibatnya, kristal menjadi penipuan dan rapuh; Tapi brilian, karena chrome.
Jika lapisan yang sama ini divisualisasikan dari perspektif lateral, itu akan diamati, bukan Octahedra, tetraheders yang terdistorsi:
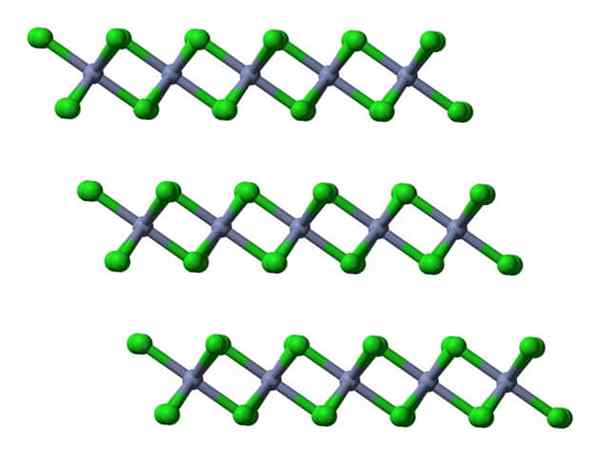 Lapisan kristal CRCL3 melihat secara lateral. Sumber: Ben Mills.
Lapisan kristal CRCL3 melihat secara lateral. Sumber: Ben Mills. Di sini pemahaman mengapa lapisan itu ditolak satu sama lain difasilitasi saat CL- dari permukaannya.
Properti
Nama
-Chrome Chloride (III)
-Chrome trichloride (III)
-Krom klorida (iii) anhidrat.
Formula Kimia
-Crcl3 (anhidrat).
-Crcl3.6h2O (hexsahing).
Berat molekul
-158.36 g/mol (anhidrat).
-266.43 g/mol (hexahidrat).
Deskripsi Fisik
-Kristal solid dan violet-redistik (anhidrat).
-Debu kristal hijau gelap (heksahidrat, gambar bawah). Dalam hidrat ini dapat dilihat sebagai air menghambat kecerahan, fitur krom logam.
 Hexahidrat Chrome Chrome. Sumber: Pengguna: Walkerma [Domain Publik]
Hexahidrat Chrome Chrome. Sumber: Pengguna: Walkerma [Domain Publik] Titik lebur
-1.152 ºC (2.106 ºF, 1.425 k) (anhidrum)
-83 ºC (hexahidrat).
Titik didih
1300 ºC (2.370 ºF, 1.570) (anhydrum).
Kelarutan air
 Larutan air chrome klorida (III). Sumber: leiem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Larutan air chrome klorida (III). Sumber: leiem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] -Sedikit larut (anhydro).
-585 g/l (hexahidrat).
Pada gambar atas serangkaian tabung reaksi yang diisi dengan larutan CRCL yang berair ditampilkan3. Perhatikan bahwa semakin terkonsentrasi, semakin intens warna kompleks [CR (oh2)6]3+, Warna hijau bertanggung jawab.
Dapat melayani Anda: putrescina: struktur, sifat, sintesis, penggunaanKelarutan dalam pelarut organik
Larut dalam etanol, tetapi tidak larut dalam eter (anhidrat).
Kepadatan
-2,87 gr/cm3 (anhidrat).
-2,76 g/cm3 (Hexahidrat).
Suhu penyimpanan
Penguraian
Saat dipanaskan hingga dekomposisi, kromium klorida (III) memancarkan asap beracun senyawa yang mengandung klorin. Senyawa ini juga dilepaskan ketika krom klorida (III) bersentuhan dengan asam yang kuat.
Korosi
Ini sangat korosif dan dapat menyerang baja tertentu.
Reaksi
Itu tidak sesuai dengan oksidan yang kuat. Itu juga bereaksi kuat dengan lithium dan nitrogen.
Ketika dipanaskan dengan adanya hidrogen, dikurangi menjadi kromium klorida (II), dengan pembentukan hidrogen klorida.
2 crcl3 + H2 => 2 CRCL2 + 2 HCl
ph
Dalam larutan berair, dan dengan konsentrasi 0,2 M: 2.4.
Perpaduan
Chrome chloride (III) hexahidrat diproduksi, bereaksi kromium hidroksida dengan asam hidroklorat dan air.
CR (oh)3 + 3 hcl +3 h2O => CRCL3.6h2SALAH SATU
Kemudian, untuk mendapatkan garam anhidra, CRCL dipanaskan3.6h2Atau di hadapan tionilo chloride, socl2, Asam klorida, dan panas:
[Cr (h2SALAH SATU)6] Cl3 + 6SOCL2 + ∆ → CRCL3 + 12 HCL + 6SO2
Atau, CRCL3 Gas klor diperoleh pada campuran kromium dan karbon oksida.
Cr2SALAH SATU3 + 3 C +CL2 => 2 CRCL3 + 3 co
Dan akhirnya, menjadi metode yang paling banyak digunakan, adalah memanaskan oksida dengan zat halogen, seperti karbon tetraklorida:
Cr2SALAH SATU3 + 3ccl4 + ∆ → 2crcl3 + 3cocl2
Aplikasi
Industrialis
Chrome chloride mengintervensi dalam persiapan di -site chrome chloride (II); reagen yang mengintervensi dalam pengurangan alkil halida, dan dalam sintesis haluros (e) -salquenilo.
Dapat melayani Anda: natrium oksalat (na2c2o4): struktur, sifat, penggunaan, risiko-Itu digunakan dalam teknik chrome. Ini terdiri dari menyimpan, melalui galvanoplasti, lapisan halus krom pada benda logam atau bahan lainnya dengan objek dekoratif, sehingga meningkatkan ketahanan korosi dan juga kekerasan permukaan.
-Ini digunakan sebagai mordan tekstil, berfungsi sebagai tautan antara bahan pewarnaan dan kain yang akan dicelup. Selain itu, ini digunakan sebagai katalis untuk produksi olefin dan agen tahan air.
Terapi
Penggunaan suplemen chrome klorida USP USP direkomendasikan pada pasien yang hanya menerima solusi intravena, yang diberikan untuk nutrisi parenteral total (TPN). Oleh karena itu, hanya jika pasien ini tidak menerima semua kebutuhan nutrisi mereka.
Chromium (III) adalah bagian dari faktor toleransi glukosa, aktivator reaksi yang dipromosikan oleh insulin. Diperkirakan bahwa kromium (III) mengaktifkan metabolisme glukosa, protein dan lipid, memfasilitasi aksi insulin pada manusia dan hewan.
Kromium hadir dalam banyak makanan. Tetapi konsentrasinya tidak melebihi 2 dengan ransum, brokoli menjadi makanan dengan kontribusi terbesar (11 μg). Selain itu, penyerapan usus krom rendah, dengan nilai 0,4 hingga 2,5% dari jumlah yang dicerna.
Ini membuatnya sulit untuk membangun diet untuk pasokan krom. Pada tahun 1989, National Academy of Sciences merekomendasikan antara 50 hingga 200 μg/hari sebagai asupan krom yang memadai.
Risiko
Di antara kemungkinan risiko konsumsi garam ini sebagai suplemen krom adalah:
-Sakit perut yang kuat.
-Pendarahan abnormal, yang dapat bervariasi dari kesulitan untuk menyembuhkan luka, memar terjauh merah, atau penggelapan produk tinja tinja pendarahan internal.
-Iritasi dalam sistem pencernaan, menyebabkan ulkus lambung atau usus.
-Infeksi kulit
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Kromium (iii) klorida. Diperoleh dari: di.Wikipedia.org
- Chromium (III) klorida [PDF]. Pulih dari: alpha.Chem.Umb.Edu
- Pubchem. (2019). Chromium chloride hexahydrate. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Institut Kesehatan Nasional. (21 September 2018). Kromium: Lembar Fakta Suplemen Diet. Diperoleh dari: SDG.Od.Nih.Pemerintah
- Tomlinson Carole a. (2019). Efek samping kromium klorida. LEAF GROUP LTD. Pulih dari: dengan sehat.com
- « Mengapa penting untuk dibaca? 10 Manfaat Membaca
- Sejarah Borax, Struktur, Properti, Penggunaan, Sintesis, Risiko »

