Struktur Kalium Bromide (KBR), Properti, Penggunaan
- 1381
- 69
- Ray Thiel
Dia Kalium bromida Ini adalah garam anorganik yang formula kimianya adalah KBR. Itu dibentuk oleh penyatuan elektrostatik anion bromida, br-, Dan kation kalium, k+, dalam proporsi 1: 1; yaitu, kami memiliki jumlah yang sama- pada k+ Dalam kristal KBR.
Kalium bromida adalah garam putih atau kristalin padat, tidak berbau, sangat larut dalam air, dan sedikit larut dalam etanol dan etanol. Itu digunakan selama bagian akhir abad ke -19 dan sebagian besar abad ke -20 dalam pengobatan epilepsi dan sebagai obat penenang.
Sampai tahun 1975 terus menjual secara bebas, tahun di mana penggunaannya menurun karena efek toksik yang dihasilkannya pada pasien. Saat ini masih digunakan pada beberapa spesies hewan dalam pengobatan kejang, meskipun dari tahun 1912 digantikan oleh natrium fenobarbital.
Kalium bromida digunakan dalam studi optik yang sesuai dengan daerah inframerah terdekat dari spektrum elektromagnetik. Itu juga berfungsi sebagai bahan yang digunakan di bidang fotografi.
[TOC]
Jenis tautan
Kalium bromida adalah garam biner, produk dari kombinasi atom brom dengan keadaan oksidasi -1, dengan atom kalium dengan keadaan oksidasi +1. Oleh karena itu, daya tarik listrik antara Ion BR ditetapkan- Dan ion k+.
Jenis interaksi listrik atau elektrostatik ini dikenal sebagai ikatan ionik, yang terdisosiasi ketika garam kalium bromida larut dalam air, melepaskan ion k+ dan br-.
Ion -ion ini hancur oleh pemilik air.
Struktur Kalium Bromida
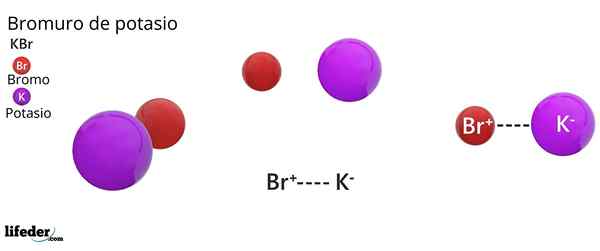
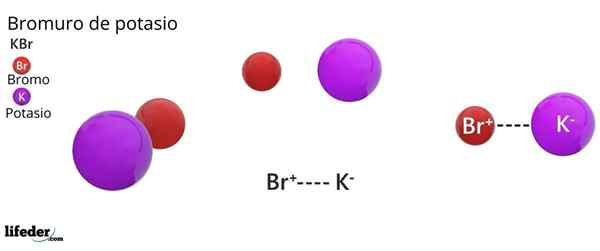
 Struktur kristal FCC dari KBR: Bola coklat sesuai dengan BR-, sedangkan bola violet sesuai dengan kation k+
Struktur kristal FCC dari KBR: Bola coklat sesuai dengan BR-, sedangkan bola violet sesuai dengan kation k+ Kalium bromida menghadirkan struktur kristal kubik yang berpusat pada wajah (FCC) Kubik yang Diterahkan Wajah), sama dengan yang diamati dalam natrium klorida.
Dapat melayani Anda: faraday constantDalam struktur ini, setiap anion br- Itu terhubung atau dikoordinasikan dengan enam k kation+, Dan pada gilirannya, masing -masing k+ Itu memiliki enam BR- sebagai tetangga di jaringan kristal.
Tata nama
Kalium bromida diklasifikasikan sebagai halida atau logam halogenida alkali atau alkali. Nama -nama garam ini dibangun dengan menghilangkan huruf terakhir dari nama halogen (klorin, bromin, yodium, fluor dan astato), dengan pengecualian fluoride, dan mengganti huruf terakhir dengan akhiran -uro. Nama logam ditulis di bawah ini tanpa modifikasi.
Misalnya: natrium klorida, kalium iodida, kalsium fluorida, dll. Itulah sebabnya KBR disebut kalium bromida atau kalium bromida (menurut nomenklatur tradisional).
Sifat kalium bromida
 Disk jam dengan butiran KBR. Sumber: Walkerma via Wikipedia.
Disk jam dengan butiran KBR. Sumber: Walkerma via Wikipedia. Penampilan fisik
Kaca tidak berwarna, kristal atau butiran putih.
Bau
WC
Rasa
Pada konsentrasi tinggi rasanya pahit dan pedas.
Masa molar
119.02 g/mol
Kepadatan
2.74 g/cm3 pada 25 ºC
Titik lebur
734 ºC
Titik didih
1435 ºC
Kelarutan air
535 g/l a 0 ºC
678 g/l a 25 ºC
1020 g/l a 100 ºC
1 gram garam dilarutkan dalam 1 ml air mendidih, yang menunjukkan bahwa itu sangat larut dalam air.
Kelarutan dalam gliserol
217 g/l
1 gram kalium bromida larut dalam 4.6 ml gliserol.
Kelarutan etanol
47.6 g/l a 80 ºC.
1 gram kalium bromida larut dalam 250 ml etanol.
Kepadatan uap
7.14 Dalam hubungan udara yang diambil sebagai unit.
Stabilitas
Stabil jika disimpan dalam kondisi yang disarankan. Tidak sesuai dengan agen pengoksidasi, asam kuat, bromin trifluorida dan bromin.
Penguraian
Saat dipanaskan hingga dekomposisi memancarkan produk berbahaya, seperti hidrogen bromida dan kalium oksida.
Dapat melayani Anda: Kernel Konfigurasi Elektronik: Konstruksi, ContohIndeks refraksi (ND)
1.559
ph
Dalam larutan berair menghasilkan pH netral, sekitar 7.
titik pengapian
1435 ºC
Pembubaran dan Reaktivitas
Dalam larutan berair, KBR sepenuhnya dipisahkan untuk menyebabkan larutan pH netral.
Garam adalah sumber bromida yang dapat digunakan untuk produksi perak bromida, AGBR, senyawa yang digunakan dalam pengembangan foto:
KBR (AC) +Agno3 (Ac) → agbr (s) +kno3 (AC)
Juga, KBR adalah zat pereduksi yang lemah, tidak sesuai dengan merkuri dan garam perak. Menghasilkan reaksi kekerasan dengan trifluorida brom. Dapat bereaksi dengan banyak garam, alkaloid dan pati.
Ini juga bereaksi dengan asam, misalnya, dengan asam sulfat pekat, melepaskan hidrogen bromida.
Aplikasi
Pengobatan epilepsi dan kejang
Sifat antikonvulsif kalium bromida pertama kali diekspos oleh Sir Charles Locock, pada pertemuan Royal Medicine and Chirurgical Society pada tahun 1857, yang mempromosikan penggunaannya dalam pengobatan epilepsi.
Kalium bromida digunakan sebagai obat prioritas dalam pengobatan epilepsi dan sebagai obat penenang sampai tahun 1912, ketika fenobarbital natrium diumumkan.
Meski begitu, itu terus digunakan sebagai pelengkap fenobarbital natrium dalam pengobatan kejang epilepsi.
Pada tahun 1975, karena karakter beracunnya, FDA U.S. (Food & Drug Administration) memutuskan untuk tidak merekomendasikan penggunaan kalium bromida, baik pada manusia maupun hewan. Namun, beberapa negara terus mengelolanya.
Kalium bromida digunakan sebagai hipnosis dan obat penenang pada sapi, kuda, domba dan babi. Itu juga digunakan dalam pengobatan kolik dan tetania pada kuda, dan dalam perawatan kejang pada anjing.
Optik inframerah
Karena transparansi kalium bromida dalam kisaran panjang gelombang antara cahaya ultraviolet dan inframerah dekat, digunakan sebagai komponen jendela untuk beberapa radiasi elektromagnetik, terutama radiasi inframerah inframerah.
Dapat melayani Anda: osmolaritasBeberapa teknik digunakan dalam hal ini. Salah satunya terdiri dari elaborasi dua cakram kristal kalium bromida, menempatkan film materi yang akan dianalisis dalam inframerah dalam album. Studi dilakukan dalam inframerah dekat antara 780 nm dan 3000 nm.
Fotografi
 KBR adalah bagian dari bahan yang digunakan untuk memproses foto -foto pertama abad kedua puluh
KBR adalah bagian dari bahan yang digunakan untuk memproses foto -foto pertama abad kedua puluh Kalium bromida telah memiliki banyak kegunaan dan aplikasi dalam fotografi, misalnya: ini telah digunakan untuk merumuskan pengembang fotografi, dalam pembuatan film fotografi, sebagai film yang tebal, dan sebagai warna pemutih warna.
Ini digunakan dalam peningkatan diferensiasi antara kristal halida perak yang terpapar dan tidak terpapar, dalam peningkatan kepadatan pencetakan negatif tipis, dan sebagai halogenida sekunder, dalam kombinasi dengan iodida, untuk pemrosesan kertas negatif di atas kertas di atas kertas.
Ini juga telah digunakan dalam kombinasi dengan merkuri bichloride, tembaga sulfat, atau kalium ferricianurio dalam pemutih fotografi. Ini juga berfungsi sebagai pembatas dalam pengembang alkali yang digunakan untuk pelat gelatin dan makalah pengembangan.
Analisis kimia
KBR digunakan dalam menentukan penilaian tembaga dan perak, dalam analisis polarografi India, kadmium dan arsenik.
Penggunaan lainnya
Ini digunakan dalam proses ukiran litografi, dalam pemrosesan minyak, dalam stabilisasi termal nilon, dalam pembuatan serat, dan akhirnya dalam pembuatan sabun khusus.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Hari, r., & Underwood, a. (1986). Kimia analitik kuantitatif (Edisi kelima.). Pearson Prentice Hall.
- Wikipedia. (2020). Kalium bromida. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2021). Kalium bromida. Ringkasan Pubchem Comunund untuk CID 253877. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- EMEA. (1999). Bromide, Garam Kalium: Laporan Ringkasan. [PDF]. Dipulihkan dari: EMA.Eropa.UE
- Sevier b.V. (2020). Kalium bromida. Ilmiah. Diperoleh dari: Scientedirect.com

