Asam lemah
- 710
- 175
- Ernesto Mueller
 Contoh asam lemah
Contoh asam lemah Apa itu asam lemah?
Asam lemah adalah yang dalam larutan berair memiliki sedikit kapasitas untuk memisahkan dalam hidrogen (h+) dan di dasar terkonjugasi yang sesuai. Tidak seperti asam kuat, yang disosiasinya lengkap (100%) dan praktis tidak dapat diubah, asam lemah hampir tidak ada dan reversibel dan reversibel.
Oleh karena itu, asam lemah menghasilkan lebih sedikit hones h+ Di air apa yang diharapkan. Di antara asam lemah yang paling representatif kami memiliki asam asetat, komponen utama cuka, yang kira -kira dalam 0.5 % dalam kondisi normal.
Ini berarti bahwa proporsi terbesar dari larutan asam asetat dalam air, seperti cuka masak 5%, dalam bentuk yang tidak didasarkan pada (CH3Cooh); Sementara sebagian kecil ditemukan sebagai basis konjugat (pilih3Mendekut-), disertai dengan ion H+, atau lebih tepatnya, ion H3SALAH SATU+.
Kemudian, karena jumlah hidrogen yang dilepaskan oleh asam lemah dalam larutan berair rendah, pH yang mereka hasilkan lebih tinggi (dasar) daripada yang dihasilkan oleh asam yang kuat. Misalnya, cuka memiliki pH 2.5, jus jeruk pH 3.3. 4.2 dan 2 jus lemon 2.
PH ini, meskipun asam, lebih tinggi dari pH yang menghasilkan larutan asam kuat (HCl, h2Sw4, dll.) bahwa mereka dapat mencapai nilai 1 atau kurang (nilai pH negatif).
Karakteristik asam lemah
pH solusi Anda
Asam lemah biasanya memiliki pH antara 2.0 dan kurang dari 7.0, jadi mereka memutar warna kertas pannasol dengan warna merah. Nilai pH ini banyak lebih tinggi dari nilai pH yang dihasilkan oleh asam kuat, meskipun ada pengecualian.
Misalnya, larutan asam klorida 1 mM (asam kuat), memiliki pH 3.0, sedangkan larutan asam fluorhorat 1 mm (asam "lemah"), memiliki pH 3.2, yang dekat dengan asam kuat.
Ionisasi parsial
Asam lemah dalam larutan terionisasi sedikit atau sebagian dalam air, memisahkan dalam basa terkonjugasi asam dan hidrogen ion. Kemudian, asam lemah dalam larutan berair sebagian besar terdisosiasi, dengan proporsi kecil yang terdisosiasi.
Dapat melayani Anda: menyeimbangkan persamaan kimiaKetika jumlah hidrogen yang dilepaskan oleh asam lemah dalam air rendah, pH yang diproduksi oleh asam ini lebih tinggi daripada yang dihasilkan oleh asam kuat yang dilarutkan dalam air, karena ini biasanya terionisasi sebesar 100 %.
Ionisasi reversibel
Ionisasi asam lemah biasanya ditempatkan sebagai berikut:
Memiliki ⇌ a- + H3SALAH SATU-
Dimana ada asam lemah, untuk- basis terkonjugasi, dan h3SALAH SATU+ kation hidronium, yang merupakan jalan di h+ Itu ada atau dimanifestasikan di dalam air. Konsentrasi (atau aktivitas) h3SALAH SATU+ Itu digunakan sebagai ganti h+ Untuk penentuan larutan solusi.
Gelar ionisasi
Beberapa asam lebih lemah dari yang lain, yang sama untuk dikatakan, mereka kurang terionisasi. Oleh karena itu, tingkat ionisasi memungkinkan kita untuk melihat seberapa asam asam dalam kondisi tertentu.
Untuk mengekspresikan tingkat ionisasi, beberapa parameter diperkenalkan, seperti ionisasi atau konstanta keasaman (KA) dan PKA: cara mengekspresikan KA dalam jumlah sederhana yang menghilangkan penggunaan jumlah yang diekspresikan dalam kekuatan negatif sepuluh (10 ), seperti yang ada di KA.
Konstanta KA dan PKA terutama digunakan untuk asam lemah.
Ka = [a-] [H+] / [Ha]
Kurung yang ada dalam formula mewakili konsentrasi.
pKa = - log ka
Nilai PKA dari asam lemah biasanya berkisar antara 2 dan 12. Tapi ada pengecualian. Misalnya: dan dan asam odagik (HIO3) memiliki pKa 0.77, yang dianggap sebagai nilai yang relatif kecil, tetapi tanpa menjadi negatif, untuk asam lemah dalam arti yang ketat.
Stabilitas dasar konjugasi
Asam lemah memiliki ikatan yang kuat dengan atom hidrogen asam (hδ+-Xδ-), jadi mereka memiliki tingkat disosiasi hidrogen yang rendah. Ini menghasilkan basa terkonjugasi asam lemah memiliki aviditas besar oleh hidrogen, menjadi basa terkonjugasi yang kuat.
Dapat melayani Anda: koloidYaitu, basa terkonjugasi asam lemah sangat tidak stabil, karena menerima h+ dikembalikan dengan sangat mudah. Semakin tidak stabil basa terkonjugasi ini, semakin lemah asam akan dipertanyakan.
Konduktivitas ionik rendah
Menjadi sedikit terionisasi, asam lemah adalah konduktor listrik yang buruk, tidak seperti asam kuat yang merupakan konduktor listrik yang baik.
Kehadiran di alam
Asam lemah didistribusikan secara luas di alam, misalnya, mereka berada dalam buah jeruk (lemon, grapefruit, oranye, dll).
Mereka juga hadir dalam berbagai proses yang terjadi pada semua makhluk hidup. Beberapa asam lemah biologis ini adalah piruvik, laktik, sitrat, fumaric, suksinat, glutamik, dll., dan bahkan hemoglobin teroksigenasi melepaskan hidrogenasi, jadi itu berperilaku seperti asam lemah.
Kemudian, dapat disimpulkan bahwa manusia hidup dalam kontak permanen dengan asam lemah.
Cara menghitung pH asam lemah?
PH asam lemah dapat dihitung dengan menggunakan pengasaman konstanta (KA), atau menggunakan persamaan Henderson-Haselbalch. Dalam contoh pertama ka akan digunakan.
Dengan konstanta keasaman
Hitung pH solusi 0.5 m asam benzoat (c6H5COOH), yang memiliki konstanta ionisasi (ka) = 1.8 x 10-5
C6H5COOH ⇌ c6H5Mendekut- + H+ (1)
Jika jumlah asam yang terdisosiasi disebut x, maka 0.5 M-X akan menjadi konsentrasi asam lemah yang tidak terdisosiasi dalam kesetimbangan, menjadi x konsentrasi basa konjugat asam benzoat dan konsentrasi ion hidrogen.
Persamaan (1) dapat direpresentasikan sebagai berikut:
0.5 m-x ⇌ x +x
Asam lemah terionisasi dalam proporsi yang sangat rendah, sehingga konsentrasi asam benzoat dalam keseimbangan (0.5 m-x), dapat diasumsikan sebagai 0.5 m, sejak x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Oleh karena itu, [h+] sama dengan 3 x 10-3 M. Kami menyelesaikannya dengan menghitung pH:
Itu dapat melayani Anda: Metode Mohr: Fundamental, Reaksi, Prosedur, PenggunaanpH = - log [h+]
= - log [3 x 10-3]
pH = 2.52
Perhatikan bahwa pH relatif asam, karena terletak di bawah 3 atau 4.
Dengan persamaan Henderson-Haselbalch
Persamaan Henderson-Haselbalch digunakan untuk menghitung pH solusi buffer:
pH = pKa + log [basa terkonjugasi] / [asam]
Contoh:
Sodium hidroksida (NaOH) ditambahkan ke larutan asam asetat, menghasilkan konsentrasi akhir asam asetat (CH3Cooh) 1.11 x 10-2 mol/L dan konsentrasi dasar konjugat (pilih3Mendekut-) dari 0.44 x 10-2 perempuan jalang. Jika asam asetat pka adalah 4.75 Hitung pH larutan.
pH = 4.75 +log [a-] / [Ha]
pH = 4.75 +log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
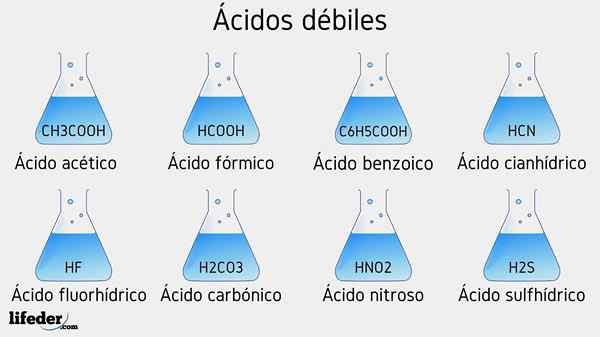
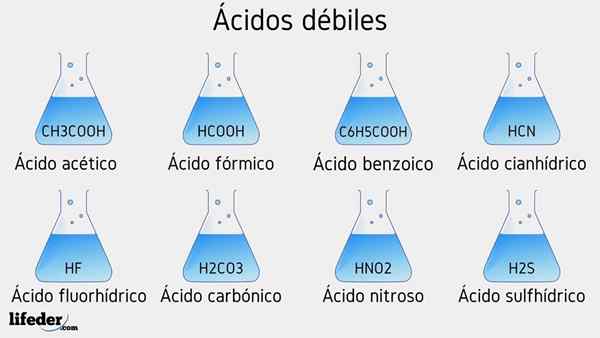
Contoh asam lemah
Beberapa asam lemah disertai dengan nilai PKA mereka akan tercantum di bawah ini:
- Ch3COOH (asam asetat), PKA 4.75
- HCOOH (asam format), PKA 3.74
- C6H5COOH (asam benzoat), PKA 5.59
- Ch2Clcooh (asam kloroasetat), PKA 2.85
- HCN (asam cyanhydric), PKA 9.31
- HF.17
- C2H5COOH (asam propionat), PKA 4.89
- Hno2 (Asam nitrat), pKa 3.35
- H2S (asam sulfida), pKa1 6.0 dan PKA2 12.92
- CCL3COOH (asam trichloroacetic), pKa 0.52
- H2BERSAMA3 (asam karbonat), pKa1 6.37 dan PKA2 10.22
- H3PO4 (Asam Fosfat), PKA1 2.12, PKA2 4.21 dan PKA3 sebelas.0
- C6H5Sw3H (asam benzefonat), pKa 0.70
- Hio3 (Asam yodium), pKa 0.77
- Hclo2 (Asam kloro), pKa 2.0
- Ch3Ch2(OH) COOH (asam laktat), PKA 3.08
Asam lemah dengan penggunaan terapeutik
- Asam salisilat, PKA 3.00
- Asam asetilsalisilat, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofen, PKA 4.40
- Levodopa, PKA 2.30
- Phenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Morris, J. G. (1974). Fisikokimia untuk ahli biologi. (Edisi ke -2.). Saya terbalik.
- Helmestine, Anne Marie, PH.D. (29 Agustus 2020). Definisi asam lemah dan contoh dalam kimia. Pulih dari: thinkco.com
- Ophardt c., & McCarthy l. (15 Agustus 2020). Kekuatan asam dan basa. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Clark Jim. (2013). Asam Kuat dan Lemah. Pulih dari: chemguide.bersama.Inggris
- Pembelajaran Lumen. (S.F.). Kimia untuk non-jurusan: Menghitung pH asam lemah dan solusi basa. Pulih dari: kursus.Lumenarning.com

