Acid-Base Arrhenius, Teori Lowry Bronsted, Lewis
- 1871
- 202
- Pete Lesch
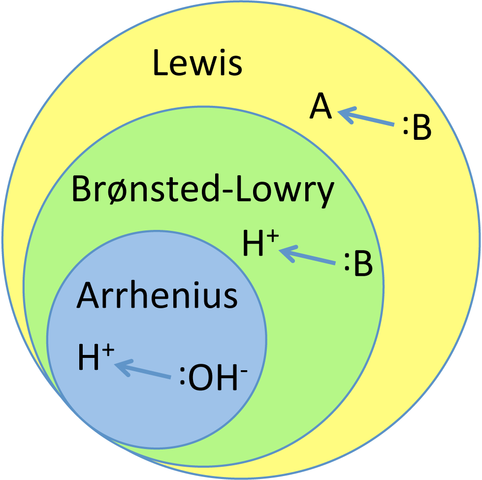
 Grafik yang menghubungkan tiga teori utama asam dan basa. Sumber: Tem5psu, CC BY-SA 3.0, via Wikimedia Commons
Grafik yang menghubungkan tiga teori utama asam dan basa. Sumber: Tem5psu, CC BY-SA 3.0, via Wikimedia Commons Apa itu Teori Asam dan Basa?
Teori asam dan basa adalah seperangkat kontribusi konseptual yang mendefinisikan dan membedakan asam dan basa, dua konglomerat zat relevansi yang sangat besar di bidang kimia.
Akarnya berasal dari karakterisasi pertama yang dibuat oleh Robert Boyle pada tahun 1661, yang mendefinisikan asam seperti zat asam dan korosif yang mengubah warna kertas pegas biru menjadi merah; Dan basa seperti zat sabun yang, tidak seperti asam, mengubah warna kertas tulang kering merah ke biru.
Antoine Lavoisier mengusulkan bahwa semua asam mengandung atom oksigen, seperti H2Sw4 dan hno3. Berabad -abad kemudian pada tahun 1811 Humphry Davy menemukan bahwa banyak asam sebenarnya tidak memiliki atom oksigen, seperti HCl, HF, HBR, dll.
Dan sesaat sebelum penampilan triad asam-basa terkenal (gambar superior), Justig Liebig menyarankan bahwa asam memiliki atom hidrogen yang dapat digantikan oleh kation logam.
Pengetahuan empiris ini berfungsi sebagai inspirasi untuk teori asam dan basa saat ini: Arrhenius, Bronssted-Lowry dan Lewis. Seperti yang terlihat dalam grafik, teori Arrhenius adalah yang paling ketat atau terbatas dari semuanya, sedangkan Lewis adalah yang paling umum dan globalisasi.
Teori Arrhenius
Diusulkan oleh tahun 1884 oleh Svante Arrhenius, teorinya mengatakan bahwa asam ketika dilarutkan dalam air menghasilkan ion h3SALAH SATU+ atau h+; Saat pangkalan, saat larut dalam air, hasilkan atau lepaskan ion OH-.
Ion h3SALAH SATU+ dan oh- Mereka menggabungkan dalam reaksi reversibel yang menimbulkan molekul air:
H3SALAH SATU+ + Oh- ⇌ 2H2SALAH SATU
Dapat melayani Anda: asam disulfuri: apa itu, struktur, sifat, penggunaanJadi, asam Arrhenius juga merupakan yang meningkatkan konsentrasi ion H3SALAH SATU+, Sedangkan pangkalan arrhenius adalah yang meningkatkan konsentrasi ion oh-.
Ini berarti bahwa asam arrhenius tidak harus mengandung ion H3SALAH SATU+, Dan basis arrhenius tidak harus memiliki ion oh- Dalam strukturnya.
Contoh dan batasan
Pertimbangkan disosiasi berikut:
HCl (AC) → H+(Ac) +cl-(AC)
NaOH (AC) → NA+(Ac) +oh-(AC)
HCl adalah asam arrhenius karena ketika dilarutkan dalam air itu menghasilkan ion H+, atau lebih tepatnya, ion H3SALAH SATU+. Dan di sisi lain, NaOH adalah dasar Arrhenius karena ketika dilarutkan dalam air, oh ion melepaskan-. Zat -zat ini bereaksi satu sama lain untuk menghasilkan garam dan air:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2SALAH SATU
Masalah dengan teori Arrhenius terletak pada fakta bahwa itu hanya terbatas pada solusi air, dan oleh karena itu, hanya berlaku untuk zat yang larut dalam air. Misalnya, MGO sangat tidak larut di dalam air, namun itu adalah oksida dasar.
Itu juga tidak dapat menjelaskan sendiri bagaimana zat seperti NH3 dan CAO menghasilkan ion OH- larut dalam air, bahkan ketika mereka tidak memiliki ion oh- Dalam struktur molekul atau kristalnya (seperti halnya NaOH atau KOH).
Dan dia tidak menjelaskan bagaimana co2 dapat melepaskan ion h3SALAH SATU+ Di dalam air tanpa memiliki atom hidrogen dalam struktur molekulnya (seperti halnya dengan HCl atau H2Sw4).
Teori Brönsted-Lowry
Proposal secara individual pada tahun 1923 oleh Johannes Bronsted dan Thomas Lewry, teori asam dan basa mereka mengatakan bahwa asam adalah semua zat yang dapat menyumbangkan ion h+, dan bahwa basis sebaliknya adalah zat apa pun yang mampu menerima h ini+. Teori ini lebih umum daripada arrhenius dan mencakup beberapa keterbatasannya.
Dapat melayani Anda: solusi molar: konsep, persiapan, contohContoh
Pertimbangkan persamaan netralisasi antara h lagi3SALAH SATU+ dan oh- Untuk menghasilkan dua molekul air:
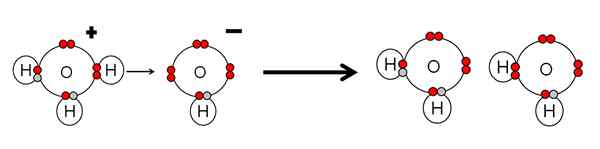 Contoh netralisasi asam dan basa air. Sumber: Gabriel Bolívar.
Contoh netralisasi asam dan basa air. Sumber: Gabriel Bolívar. Perhatikan bahwa h3SALAH SATU+ Melakukan h+ yang akan segera dihubungkan atau dikoordinasikan dengan OH- benar, benar. Kapan h+ Itu berakhir terkait dengan salah satu pasangan bebas elektron oh-, Dua molekul air netral tetap sebagai produk.
H3SALAH SATU+ Oleh karena itu adalah asam lowry brnsted, untuk menyumbangkan h+, dan oh- Ini adalah basis lowry brnsted untuk menerima h ini+.
Contoh lain dari reaksi asam-basa adalah sebagai berikut:
NH3(g) + HCl (g) → NH4Cl (S)
Reaksi ini, menurut Arrhenius, tidak dapat dianggap sebagai tipe asam-basa karena tidak terjadi dalam media berair tetapi dalam fase uap atau dalam keadaan gas. NH3 Ini adalah basis Brnsted karena menerima HCl H dengan menyumbangkan beberapa elektron yang terletak di atom nitrogen; Dan HCl, logis, menjadi asam Brnsted.
Dengan demikian, MGO adalah basis Brnsted karena mampu menerima h+ asam untuk berubah menjadi mg (OH)2.
Teori Lewis
Teori Bronsted-Lowry menjelaskan spektrum luas reaksi asam-basa. Namun, abaikan reaksi di mana ion H+ dan oh- Mereka tidak terlibat sama sekali, serta partisipasi yang lebih besar dari elektron bebas dalam mekanisme molekuler.
Jadi, pada tahun 1923 g. N. Lewis mengusulkan teori asam-basa yang mengatakan yang berikut: asam adalah zat apa pun yang mampu menerima pasangan elektron, sedangkan basa adalah yang menyumbangkan pasangan elektron ini.
Ini dapat melayani Anda: DAPI (4 ', 6-diamidino-2-fenylindol): Karakteristik, fondasi, penggunaanMisalnya, ion h+ Ini adalah asam Lewis karena menerima pasangan elektron dari spesies apa pun di sekitar: dari h2Atau berasal dari H3SALAH SATU+, dari NH3 Untuk berasal nh4+, dll.
Contoh dan keuntungan
Pertimbangkan contoh lain dalam reaksi berikut:
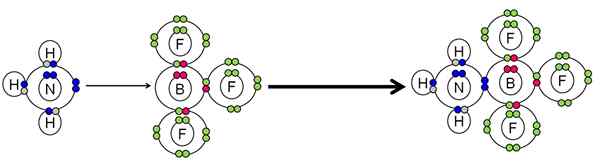 Contoh netralisasi antara asam dan basa Lewis. Sumber: Gabriel Bolívar.
Contoh netralisasi antara asam dan basa Lewis. Sumber: Gabriel Bolívar. NH3 Dilakukan sepasang elektron (biru) atom nitrogen ke atom boron bf3. Oleh karena itu, NH3 Itu adalah dasar Lewis karena menyumbangkan sepasang elektron, dan bf3 Itu adalah asam Lewis karena dia menerimanya.
Secara umum, kation dan spesies elektron yang buruk adalah asam Lewis, sedangkan anion dan spesies elektron -kaya adalah basa Lewis.
Keuntungan yang ditawarkan.
Misalnya: h2O Memiliki elektron gratis dalam oksigen. Jika Anda menyumbangkan salah satu dari mereka ke ion h+, akan bertindak sebagai pangkalan Lewis, menjadi h+ Akibatnya asam Lewis.
Menurut Bronsted-Lowry, H2Atau saya akan bertindak sebagai basis karena itu tepat menerima h+ Dengan menyumbangkan beberapa elektron gratis mereka. Dan akhirnya, h2Atau juga merupakan basis menurut teori Arrhenius karena konsentrasi ion H berkurang+ di lingkungan yang berair, dan akibatnya meningkatkan konsentrasi ion OH-.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Clark Jim. (2002). Teori asam dan basa. Pulih dari: chemguide.bersama.Inggris
- Broderick c., Moussa m., & Clark J. (21 Agustus 2020). Gambaran Umum Asam dan Basa. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Wikipedia. (2020). Reaksi asam-basa. Diperoleh dari: di.Wikipedia.org
- Universitas A&M Texas. (S.F.). Asam dan basa: Pengembangan asam dan basa. Pulih dari: chem.TAMU.Edu

