Perubahan jenis negara dan karakteristiknya (dengan contoh)
- 3856
- 1049
- Domingo Gutkowski
Itu Perubahan Negara atau fase adalah fenomena termodinamika di mana materi mengalami perubahan fisik reversibel. Dikatakan bahwa itu adalah termodinamika karena transfer panas terjadi antara materi dan lingkungan; Atau apa yang sama, ada interaksi antara materi dan energi yang menginduksi penataan ulang partikel.
Partikel -partikel yang mengalami perubahan status tetap sama sebelum dan sesudah yang sama. Tekanan dan suhu adalah variabel penting dalam bagaimana ini ditampung dalam satu fase atau yang lain. Ketika perubahan keadaan terjadi, sistem biphasic terbentuk, terdiri dari materi yang sama dalam dua keadaan fisik yang berbeda.
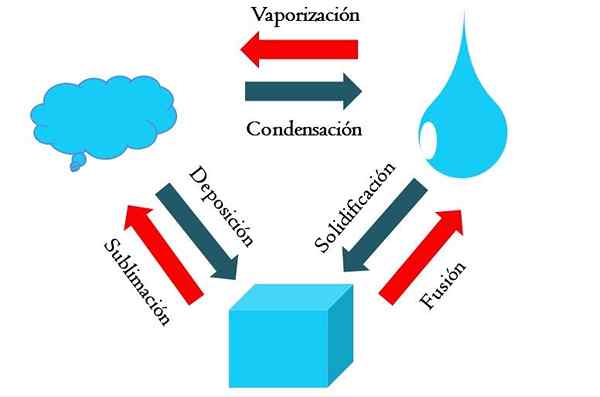
 Perubahan Negara. Sumber: Gabriel Bolívar
Perubahan Negara. Sumber: Gabriel Bolívar Gambar yang lebih tinggi menunjukkan perubahan utama keadaan yang penting dalam kondisi normal.
Kubus padat dari zat kebiruan bisa menjadi cair atau gas tergantung pada suhu dan tekanan lingkungannya. Dengan sendirinya itu mewakili satu fase: padatan. Tapi, pada saat meleleh, yaitu, meleleh, keseimbangan cair yang disebut fusi (panah merah antara ember dan tetesan biru ditetapkan).
Untuk membuat fusi terjadi, kubus perlu menyerap panas dari lingkungannya untuk meningkatkan suhunya; Oleh karena itu, ini adalah proses endotermik. Setelah kubus cair, sekali lagi satu fase: itu dari keadaan cair.
Blota ini dapat terus menyerap panas, yang meningkatkan suhunya dan menimbulkan pembentukan gelembung gas. Sekali lagi, ada dua fase: satu cairan dan soda lainnya. Ketika semua cairan telah menguap melalui titik didihnya, kemudian dikatakan bahwa ia telah mendidih atau menguap.
Sekarang, tetes kebiruan diubah menjadi awan. Sejauh ini, semua proses telah menjadi endotermal. Gas kebiruan dapat terus menyerap panas sampai dipanaskan; Namun, mengingat kondisi terestrial, sebaliknya cenderung mendingin dan mengembun lagi dalam cairan (kondensasi).
Di sisi lain, awan juga dapat disimpan secara langsung dalam fase padat, membentuk kubus padat lagi (deposisi). Dua proses terakhir ini bersifat eksotermik (panah biru); yaitu, mereka melepaskan panas ke lingkungan atau sekitar.
Selain kondensasi dan deposisi, ada perubahan keadaan ketika blota membeku pada suhu rendah (pemadatan).
[TOC]
Jenis Perubahan Negara dan Karakteristiknya
Gambar menunjukkan perubahan khas untuk tiga keadaan materi (paling umum): padat, cair dan gas. Perubahan yang disertai dengan panah merah adalah endotermik, mereka menyiratkan penyerapan panas; Sedangkan yang disertai dengan panah biru adalah eksotermik.
Deskripsi singkat dari masing -masing perubahan ini akan dilakukan di bawah ini, menyoroti beberapa karakteristiknya dari penalaran molekuler dan termodinamika.
- Fusi
Fusi adalah perubahan keadaan suatu zat dari keadaan padat menjadi cairan.

Dalam keadaan padat partikel (ion, molekul, kelompok, dll.) adalah "tahanan", terletak di posisi tetap ruang tanpa bisa bergerak dengan bebas. Namun, mereka dapat bergetar pada frekuensi yang berbeda, dan jika ini sangat kuat, urutan ketat yang dikenakan oleh kekuatan antarmolekul akan mulai "hancur.
Akibatnya, dua fase diperoleh: satu di mana partikel terus terbatas (padat), dan satu lagi di mana mereka lebih bebas (cairan), cukup untuk meningkatkan jarak yang memisahkan mereka satu sama lain. Untuk mencapai hal ini, padatan harus menyerap panas, dan dengan demikian partikelnya akan bergetar dengan gaya yang lebih besar.
Itu dapat melayani Anda: massa atom: definisi, tipe, cara menghitungnya, contohKarena alasan ini fusi adalah endotermik, dan ketika dimulai, dikatakan bahwa keseimbangan antara fase solid-cair terjadi.
Panas yang diperlukan untuk menimbulkan perubahan ini disebut panas atau entalpi meleleh (ΔHFus). Ini mengekspresikan jumlah panas (energi, dalam unit KJ terutama) yang harus menyerap mol zat keadaan padat untuk meleleh, dan tidak hanya menaikkan suhunya.
Semakin bertambah
 Salju mencair dengan tangan. Sumber: Pixabay
Salju mencair dengan tangan. Sumber: Pixabay Dengan pemikiran ini, dapat dipahami mengapa bola salju meleleh di tangan (citra superior). Salju menyerap panas tubuh, yang cukup untuk menaikkan suhu salju di atas 0 ° C.
Kristal es yang ada di salju menyerap panas yang tepat untuk meleleh dan sehingga molekul air mereka mengadopsi struktur yang lebih tidak teratur. Sementara salju meleleh, air yang terbentuk tidak akan meningkatkan suhunya, karena semua panas tangan mengambil keuntungan dari salju untuk menyelesaikan fusi.
- Penguapan

Penguapan adalah perubahan keadaan suatu zat dari keadaan cair ke gas.
Melanjutkan dengan contoh air, sekarang menempatkan segenggam salju di dalam panci dan menyalakan api, diamati bahwa salju dengan cepat meleleh. Saat air dipanaskan, gelembung karbon dioksida kecil dan kemungkinan pengotor gas lainnya mulai terbentuk.
 Air mendidih. Sumber: Pixabay
Air mendidih. Sumber: Pixabay Panas melebar secara molekuler konfigurasi air yang tidak teratur, memperluas volumenya dan meningkatkan tekanan uapnya; Oleh karena itu, ada beberapa molekul yang luput dari produk permukaan peningkatan penguapan.
Air cair meningkatkan suhunya secara perlahan, karena panas spesifiknya yang tinggi (4.184J/° C ∙ g) g). Ada titik di mana panas yang menyerap tidak lagi menggunakannya untuk menaikkan suhunya, tetapi untuk memulai keseimbangan uap-cairan; Yaitu, mulai mendidih dan semua cairan akan melewati keadaan gas sambil menyerap panas dan menjaga suhu tetap konstan.
Di sinilah gelembung intens diamati pada permukaan air rebus (gambar superior). Panas yang menyerap air cair sehingga tekanan uap dari gelembung yang baru jadi sama dengan tekanan eksternal, disebut entalpi penguapan (ΔHUap).
Peran tekanan
Tekanan juga menentukan dalam perubahan negara. Apa pengaruhnya terhadap penguapan? Bahwa pada tekanan yang lebih besar, semakin besar panas yang harus menyerap air untuk mendidih, dan oleh karena itu, diuapkan di atas 100 ° C.
Ini karena peningkatan tekanan membuatnya sulit untuk keluar dari molekul air dari fase cair ke soda.
Pot tekanan menggunakan fakta ini untuk memanaskan makanan dalam air pada suhu di atas titik didihnya.
Di sisi lain, mengalami ruang hampa atau penurunan tekanan, air cair membutuhkan suhu yang lebih rendah untuk mendidih dan bergerak ke fase gas. Dengan banyak atau sedikit tekanan, pada saat merebus air perlu menyerap panas penguapan masing -masing untuk menyelesaikan perubahan keadaannya.
- Kondensasi
Kondensasi adalah perubahan keadaan suatu zat dari keadaan gas ke keadaan cair.
Dapat melayani Anda: galaktosa
Air telah menguap. Apa berikutnya? Uap air masih bisa meningkatkan suhunya, menjadi arus berbahaya yang mampu menyebabkan luka bakar yang serius.
Namun, sebaliknya anggaplah itu mendingin. Sebagai? Melepaskan panas ke lingkungan, dan ketika dilepaskan panas dikatakan bahwa proses eksotermik sedang terjadi.
Dengan melepaskan panas, molekul gas yang sangat energi mulai melambat. Juga, interaksinya mulai lebih efektif saat suhu uap turun. Pertama, tetesan air, kondensat uap, diikuti oleh tetes yang lebih besar yang akhirnya tertarik pada gravitasi akan terbentuk.
Untuk benar -benar mengondiskan sejumlah uap, Anda perlu melepaskan energi yang sama, tetapi dengan tanda yang berlawanan, di ΔHUap; yaitu entalpi kondensasinya ΔHCond. Dengan demikian, keseimbangan terbalik, uap-cair stabil.
Jendela yang dibasahi
 Kondensasi air. Sumber: Pexels
Kondensasi air. Sumber: Pexels Kondensasi dapat diamati di jendela rumah tangga itu sendiri. Dalam cuaca dingin, uap air yang terkandung di dalam rumah bertabrakan dengan jendela, yang oleh bahannya memiliki suhu lebih rendah dari permukaan lainnya.
Di sana, lebih mudah bagi molekul uap untuk dikelompokkan, menciptakan lapisan keputihan tipis yang mudah dilepas dengan tangan. Saat molekul -molekul ini melepaskan panas (kaca pemanas dan udara), mereka mulai membentuk lebih banyak kelompok sampai mereka dapat memadatkan tetesan pertama (gambar atas).
Saat tetes sangat meningkatkan ukurannya, mereka meluncur melalui jendela dan meninggalkan jejak air.
- Solidifikasi
Solidifikasi adalah perubahan keadaan zat dari keadaan cair ke keadaan padat.

Solidifikasi terjadi karena pendinginan; Dengan kata lain, air membeku. Untuk membeku, air harus melepaskan jumlah panas yang sama yang menyerap es untuk meleleh. Sekali lagi, panas ini disebut solidifikasi atau entalpi beku, ΔHCong (-ΔHFus).
Saat mendinginkan, molekul air kehilangan energi dan interaksi antar molekulnya menjadi lebih kuat dan lebih terarah. Akibatnya, mereka dipesan berkat jembatan hidrogen mereka dan membentuk kristal es yang disebut SO. Mekanisme kristal es tumbuh dampak pada penampilannya: transparan atau putih.
 Pahatan es. Sumber: Pixabay
Pahatan es. Sumber: Pixabay Jika kristal es tumbuh sangat lambat, ini tidak menyumbat kotoran, seperti gas yang pada suhu rendah dilarutkan dalam air. Dengan demikian, gelembung melarikan diri dan tidak dapat berinteraksi dengan cahaya; Dan akibatnya, ada es yang transparan seperti patung es yang luar biasa (gambar superior).
Hal yang sama yang terjadi dengan es, dapat terjadi dengan zat lain yang dikurung dengan pendinginan. Mungkin ini adalah perubahan fisik yang paling kompleks dalam kondisi terestrial, karena beberapa polimorf dapat diperoleh.
- Sublimasi
Sublimasi adalah perubahan keadaan suatu zat dari padatan ke gas.

Bisa menyirami sublim? Tidak, setidaknya tidak dalam kondisi normal (t = 25 ° C, p = 1 atm). Untuk sublimasi terjadi, yaitu perubahan keadaan padat gas, tekanan uap padatan harus tinggi.
Demikian juga, sangat penting bahwa kekuatan antarmolekulnya tidak terlalu kuat, lebih disukai jika mereka hanya terdiri dari kekuatan dispersi
Contoh paling lambang adalah yodium padat. Ini adalah padatan kristal dari nada moral abu-abu, yang memiliki tekanan uap tinggi. Begitulah demikian, dalam tindakannya, uap ungu mengikuti, yang volume dan ekspansinya terkenal ketika dia berada di bawah pemanasan.
Dapat melayani Anda: triethilamine: struktur, sifat, penggunaan dan risiko Sublimasi yodium. Sumber: Belkina N V [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)], dari Wikimedia Commons
Sublimasi yodium. Sumber: Belkina N V [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)], dari Wikimedia Commons Pada gambar atas percobaan khas ditunjukkan di mana yodium padat menguap dalam wadah kaca. Sangat menarik dan mencolok untuk mengamati bagaimana uap ungu disebarluaskan, dan siswa yang diinisiasi dapat memverifikasi tidak adanya yodium cair.
Ini adalah karakteristik utama sublimasi: tidak ada adanya fase cair. Ini juga endotermik, karena padatan menyerap panas untuk meningkatkan tekanan uapnya sama dengan tekanan eksternal.
- Endapan
 Iodo Crystal Depposition. Sumber: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons
Iodo Crystal Depposition. Sumber: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons Deposisi adalah perubahan keadaan suatu zat dari keadaan gas ke keadaan padat.
Sejajar dengan eksperimen sublimasi yodium, Anda memiliki deposisi itu. Deposisi adalah perubahan atau transisi yang berlawanan: zat tersebut ditularkan dari keadaan gas ke padatan tanpa pembentukan fase cair.
Saat uap ungu yodium bersentuhan dengan permukaan dingin, mereka melepaskan panas untuk memanaskannya, kehilangan energi dan menyusun kembali molekul mereka lagi di padatan mudy keabu-abuan (gambar superior). Itu kemudian proses eksotermik.
Deposisi ini banyak digunakan untuk sintesis bahan di mana mereka doping dengan atom logam melalui teknik canggih. Jika permukaannya sangat dingin, pertukaran panas di antara itu dan partikel uap tiba -tiba, menghilangkan lorong melalui fase cair masing -masing.
Panas atau entalpi deposisi (dan tidak Endapan) adalah sublimasi (ΔHSub=- ΔHD.E.P). Secara teori, banyak zat dapat disublimasikan, tetapi untuk mencapai ini perlu untuk memanipulasi tekanan dan suhu, selain memiliki diagram P vs T yang ada; di mana, fase jauh mereka yang mungkin dapat divisualisasikan.
Perubahan negara lainnya
Meskipun tidak disebutkan, ada keadaan lain materi. Terkadang mereka ditandai dengan memiliki "sedikit masing -masing", dan karena itu kombinasi dari mereka. Untuk menghasilkannya, tekanan dan suhu harus dimanipulasi menjadi magnitudo yang sangat positif (besar) atau negatif.
Jadi, misalnya, jika gas dipanaskan sangat, mereka akan kehilangan elektron dan inti yang dimuat secara positif dalam gelombang negatif itu akan membentuk apa yang dikenal sebagai plasma. Ini sinonim untuk "gas listrik", karena menyajikan konduktivitas listrik yang tinggi.
Di sisi lain, ketika suhu turun terlalu banyak, materi dapat berperilaku tidak diduga; yaitu, mereka menunjukkan sifat unik di sekitar absolute nol (0 k).
Salah satu sifat ini adalah berlebihan dan superkonduktivitas; serta pembentukan kondensat Bose-Einstein, di mana semua atom berperilaku sebagai satu.
Bahkan beberapa investigasi menunjukkan materi fotonik. Di dalamnya partikel radiasi elektromagnetik, foton, dikelompokkan untuk membentuk molekul fotonik. Yaitu, itu akan memberikan massa pada beberapa tubuh cahaya, secara teoritis.
Referensi
- Helmestine, Anne Marie, PH.D. (19 November 2018). Daftar Perubahan Fase Antara Status Materi. Pulih dari: thinkco.com
- Wikipedia. (2019). Keadaan materi. Diperoleh dari: di.Wikipedia.org
- Dorling Kindersley. (2007). Mengubah keadaan. Pulih dari: factmonster.com
- Meyers Ami. (2019). Perubahan fase: evaporion, kondensasi, frezing, peleburan, sublimasi & deposisi. Belajar. Pulih dari: belajar.com
- Bagley m. (11 April 2016). Materi: Definisi & Lima Negara Materi. Dipulihkan dari: LiveScience.com
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- « Hukum Kedua Rumus Termodinamika, Persamaan, Contoh
- Struktur Kalium Iodide (KI), Properti, Perolehan, Penggunaan, Risiko »

