Struktur Kalium Iodide (KI), Properti, Perolehan, Penggunaan, Risiko

- 1458
- 15
- Frederick Pfeffer
Dia Kalium iodida Ini adalah senyawa anorganik yang dibentuk oleh ion kalium (k+) dan ion iodida (i-). Formula kimianya adalah ki. Ini adalah padatan kristal putih, sifat ionik dan sangat larut dalam air.
Ki memungkinkan beberapa reaksi kimia dan analisis dan digunakan untuk mengukur jumlah ozon di atmosfer. Ini juga digunakan dalam Peralatan Analisis Infrared (IR).
 Kalium ki ki solid. Ondřej Mangl [domain publik]. Sumber: Wikimedia Commons.
Kalium ki ki solid. Ondřej Mangl [domain publik]. Sumber: Wikimedia Commons. Kalium iodida ditambahkan ke garam meja umum untuk mencegah kekurangan yodium pada orang, karena ini dapat merupakan masalah kesehatan yang serius.
Ini digunakan sebagai ekspekoran karena membantu lendir dapat mengalir dengan mudah dari saluran pernapasan di luar. Ini juga berfungsi untuk mengobati beberapa infeksi jamur dan digunakan dalam beberapa kosmetik.
Ini digunakan oleh dokter hewan untuk menyembuhkan hewan dari masalah yang mirip dengan manusia, seperti infeksi batuk dan kulit. Bahkan ditambahkan dalam jumlah yang sangat kecil untuk hewan untuk hewan.
[TOC]
Struktur
Kalium iodida adalah senyawa ionik yang dibentuk oleh kation kalium k+ Dan yoduro i anion-, Oleh karena itu, di antara mereka tautannya adalah ionik. Status oksidasi kalium adalah +1 dan valencia del iodine adalah -1.
 Kalium iodida adalah senyawa ionik. Penulis: Marilú Stea.
Kalium iodida adalah senyawa ionik. Penulis: Marilú Stea. Kristal Kalium Iodida Ki adalah kubik.
 Struktur Kalium Ki. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Struktur Kalium Ki. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Tata nama
- Kalium iodida
- Kalium iodida
Properti
Keadaan fisik
Solid putih kristal. Kristal kubik.
Berat molekul
166.003 g/mol
Titik lebur
681 ºC
Titik didih
1323 ºC
Kepadatan
3.13 g/cm3
Kelarutan
Sangat larut dalam air: 149 g/100 g air pada 25 ° C. Sedikit larut dalam etanol dan eter.
Dapat melayani Anda: neon: sejarah, sifat, struktur, risiko, penggunaanph
Solusi berairnya netral atau basa, dengan pH antara 7 dan 9.
Sifat kimia
Sedikit higroskopis di udara lembab.
Itu stabil di udara kering. Cahaya dan kelembaban mempercepat dekomposisinya dan warnanya berubah menjadi kuning karena pelepasan sejumlah kecil yodium (i2) dan yodatos (io3-).
Solusi berair ki juga menjadi kuning dari waktu ke waktu, namun, dengan sedikit alkali ini dapat dihindari.
Solusi ini larut untuk yodium (i2) Memberi ki3:
yo- + yo2 → i3-
Properti lainnya
Ini memiliki rasa yang sangat pahit dan salin. Itu tidak mudah terbakar.
Memperoleh
Kalium iodida dapat diperoleh dengan memanaskan yodium (i2) Dalam larutan kalium hidroksida (KOH): terkonsentrasi:
3 i2 + 6 KOH → 5 KI + KIO3 + H2SALAH SATU
Larutan yodato dan iodida yang dihasilkan dipanaskan untuk menghilangkan air, dikurangi hingga kering, batubara ditambahkan dan dipanaskan pada suhu tinggi. Batubara mengambil oksigen dari iodat dan mengoksidasi karbon dioksida sehingga mengurangi iodida menjadi iodida:
2 kio3 + C → 2 ki + 3 co2
Kalium iodida yang diperoleh dapat direkripsi untuk memurnikannya. Yaitu, ditemukan kembali dalam air dan menginduksi untuk mengkristal lagi.
Aplikasi
Dalam pengobatan hipertiroidisme
Kalium iodida berfungsi sebagai pengobatan tambahan bersama dengan agen antitiroid lainnya untuk mengobati hipertiroidisme.
Hipertiroidisme adalah penyakit yang menyebabkan kelenjar tiroid menghasilkan terlalu banyak hormon tiroid, dengan peningkatan ukuran tiroid, penurunan berat orang, yang dipercepat detak jantung dan mudah marah, di antara gejala lainnya.
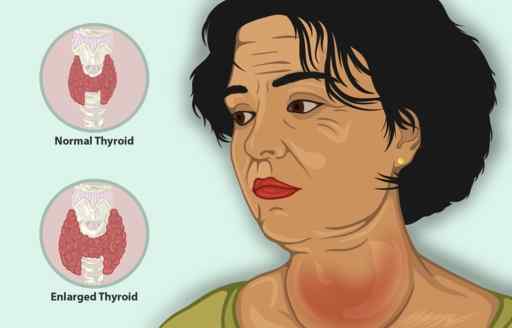 Wanita dengan tiroid yang meradang. Itu dapat diobati dengan ki kalium iodida. https: // www.Myupchar.com/in [cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Wanita dengan tiroid yang meradang. Itu dapat diobati dengan ki kalium iodida. https: // www.Myupchar.com/in [cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Pada pasien dengan hipertiroidisme, KI dengan cepat mengurangi gejala karena menghambat pelepasan hormon tiroid.
Efek tiroidnya adalah: mengurangi jumlah pembuluh darah kelenjar, penegasan kembali jaringan mereka dan mengurangi ukuran sel mereka.
Untuk alasan ini ini berlaku sebagai pengobatan pra operasi untuk menginduksi involusi atau penurunan ukuran tiroid sebelum tiroidektomi (penghilangan tiroid) karena operasi ini difasilitasi.
Dapat melayani Anda: Sodium: Sejarah, Struktur, Sifat, Risiko dan PenggunaanDalam aplikasi medis lainnya
Kalium iodida memiliki sifat ekspekoran karena sekresi cairan pernapasan meningkat, mengakibatkan penurunan viskositas lendir.
 Kalium iodida dapat bertindak sebagai ekspekoran dalam perawatan batuk. Penulis: анастаball геп. Sumber: Pixabay.
Kalium iodida dapat bertindak sebagai ekspekoran dalam perawatan batuk. Penulis: анастаball геп. Sumber: Pixabay. Ini berfungsi untuk pengobatan eritema nodoso, yang merupakan peradangan yang menyakitkan di kaki di mana nodul memerah dan peningkatan suhu terbentuk.
Adalah agen antihongos. Ini memungkinkan untuk mengobati sporotrosis yang merupakan infeksi kulit yang disebabkan oleh jamur. Penyakit ini terjadi pada orang yang bekerja dengan tanaman dan tanah, seperti petani dan tukang kebun.
Ini juga digunakan dalam pengobatan kekurangan yodium atau untuk menghindarinya dan karenanya menambah garam meja atau garam yang dapat dimakan (natrium klorida NaCl) sebagai sumber yodium dan kadang -kadang dalam air untuk diminum.
Dalam aplikasi hewan
Kalium iodida diberikan pada hewan sebagai antitutif, untuk meningkatkan dan mencairkan cairan saluran pernapasan, untuk batuk kronis bronkial, serta dalam kasus rematik dan sebagai anti -inflamasi anti -inflamasi.
Ini juga berfungsi untuk mikosis (infeksi jamur) hewan, untuk mengurangi gatal dan untuk timbal kronis atau keracunan merkuri.
Dalam perlindungan kelenjar tiroid dalam keadaan darurat radioaktif
Kalium iodide memiliki sifat pelindung tiroid jika orang tersebut telah terpapar radiasi nuklir.
KI membanjiri tiroid dengan yodium non -radioaktif sehingga menghalangi pengambilan molekul radioaktif dan penyerapan yodium radioaktif, melindungi kelenjar tiroid dari kanker yang dapat menyebabkan radiasi.
Dalam ukuran ozon di atmosfer
Gas ozon (atau3) Dapat diukur di atmosfer menggunakan sel -sel elektrolitik yang disebut ozonosanda, yang diangkut dengan balon radiosondas.
Dapat melayani Anda: benchilo benzoateSel -sel elektrolitik ini mengandung larutan kalium iodida Ki. Sel awalnya dalam keseimbangan kimia dan listrik.
Saat sampel udara dengan ozon (atau3) Menembus salah satu sel keseimbangan rusak karena reaksi berikut terjadi:
2 ki + atau3 + H2O → i2 + SALAH SATU2 + 2 koh
Reaksi ini menghasilkan arus listrik yang mengalir antar sel.
Jumlah arus listrik yang diproduksi terus menerus ditransmisikan oleh gelombang radio ke stasiun di darat. Dengan cara ini profil ozon yang berasal dari tanah ke ketinggian bola diperoleh.
 Balon Take -Off dengan Radiosonda dengan Ki untuk mengukur ozon. Hannes Grobe 19:27, 20 Juni 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Jerman [CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/2.5)]. Sumber: Wikimedia Commons.
Balon Take -Off dengan Radiosonda dengan Ki untuk mengukur ozon. Hannes Grobe 19:27, 20 Juni 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Jerman [CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/2.5)]. Sumber: Wikimedia Commons. Dalam beberapa kegunaan
Kalium iodide juga memungkinkan:
- Penghapusan radikal bebas seperti radikal hidroksil oh.
- Pembuatan emulsi fotografi, untuk mengendapkan perak.
- Tingkatkan pakan ternak saat ditambahkan dalam mikrokontitas.
- Deodorisasi pupuk sapi.
- Mengirimkan cahaya spektrum inframerah dalam peralatan analisis IR.
- Lakukan reaksi kimia tertentu dan analisis di laboratorium kimia.
- Gunakan dalam produk kebersihan pribadi.
- Melakukan analisis polusi lingkungan.
Risiko
Beberapa orang peka terhadap iodide.
Orang dengan tuberkulosis atau bronkitis akut juga harus berhati -hati.
Ki dapat menyebabkan pelunakan kelenjar ludah, dapat membakar mulut atau tenggorokan, peningkatan air liur yang tidak biasa, nyeri gigi dan peradangan gusi dan rasa logam, di antara gejala lainnya.
Anda juga bisa mengiritasi mata dan membuka luka di kulit.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Kalium iodida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Edisi keempat. John Wiley & Sons.
- Dean, J.KE. (editor). (1973). Buku Pegangan Kimia Lange. Edisi Elementh. Perusahaan Buku McGraw-Hill.
- Valkovic, v. (2019). Dekontaminasi setelah paparan radiasi. Bagian tubuh yang paling sensitif. Dalam radioaktivitas di lingkungan (edisi kedua). Pulih dari scientedirect.com.
- Smit, h.G.J. (2015). Kimia atmosfer-observasi untuk kimia (in situ). Dalam Encyclopedia of Atmospheric Sciences (Edisi Kedua). Pulih dari scientedirect.com.
- Muralikrishna, i.V. dan manickam, v. (2017). Metode Analitik untuk Memantau Penyerbukan Lingkungan. Dalam manajemen lingkungan. Pulih dari scientedirect.com.
- Wallace, J.M. dan hobbs, p.V. (2006). Kimia Atmosfer 1. In Atmospheric Science (Edisi Kedua). Pulih dari scientedirect.com.

