Struktur Lithium Carbonate (LI2CO3), Properti, Penggunaan

- 3956
- 837
- Leland Robel
Dia lithium karbonat Ini adalah padatan anorganik yang dibentuk oleh dua lithium li+ dan co anion karbonat32-. Formula kimianya adalah li2BERSAMA3. Li2BERSAMA3 Ini adalah padatan kristal putih yang dapat diperoleh dengan reaksi antara lithium hidroksida dan karbon dioksida.
Lithium karbonat memiliki titik fusi yang sangat tinggi, sehingga digunakan dalam persiapan kaca, keramik dan porselen. Ini memiliki kegunaan yang sangat bervariasi, seperti baterai lithium yang dapat diisi ulang, dalam persiapan senyawa lithium lainnya, elektroda pengelasan dan dalam lukisan dan pernis.
 Lithium karbonat li2BERSAMA3 padat. Gambar diambil oleh W: Pengguna: Walkerma pada Juni 2005. Sumber: Wikimedia Commons.
Lithium karbonat li2BERSAMA3 padat. Gambar diambil oleh W: Pengguna: Walkerma pada Juni 2005. Sumber: Wikimedia Commons. Li juga digunakan2BERSAMA3 Dalam campuran semen untuk mencapai pengaturan cepat dan produksi aluminium.
Salah satu kegunaannya yang paling penting adalah dalam pengobatan beberapa penyakit mental seperti depresi dan perilaku yang sangat agresif, di antara kondisi lainnya.
Namun, penggunaannya sebagai obat harus dikendalikan oleh spesialis medis karena orang yang dirawat dengan LI2BERSAMA3 Mereka dapat menderita efek berbahaya bagi kesehatan, seperti hipotiroidisme (pengurangan fungsi kelenjar tiroid).
[TOC]
Struktur
Lithium karbonat terdiri dari dua lithium li+ dan co anion karbonat32-.
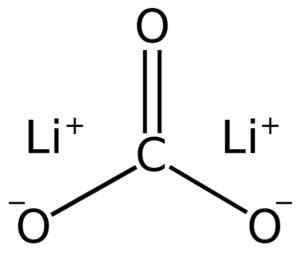 Struktur Lii Lithium Carbonate2BERSAMA3. Adrian Hands [domain publik]. Sumber: Wikimedia Commons.
Struktur Lii Lithium Carbonate2BERSAMA3. Adrian Hands [domain publik]. Sumber: Wikimedia Commons. Konfigurasi lithium elektronik dalam keadaan oksidasi +1 adalah 1s2 2s0, Nah, dia telah kehilangan elektron dari lapisan terakhir, sehingga lebih stabil. Co karbonat co32- Itu memiliki struktur datar.
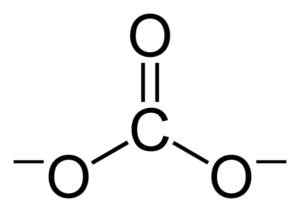 Struktur datar dari co ion batubara32-. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Struktur datar dari co ion batubara32-. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Beban negatif didistribusikan secara merata di antara tiga atom oksigen dari co ion batubara32-.
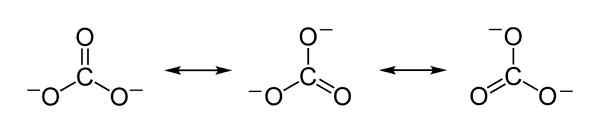 Struktur Resonansi Teoritis dari Karbonat Ion CO32- yang berfungsi untuk menjelaskan distribusi yang adil dari beban negatif antara 3 atom oksigen. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Struktur Resonansi Teoritis dari Karbonat Ion CO32- yang berfungsi untuk menjelaskan distribusi yang adil dari beban negatif antara 3 atom oksigen. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Tata nama
-Lithium karbonat
-Dilitio Carbonate
Properti fisik
Keadaan fisik
Padatan putih kristal dari struktur monoklinik
Berat molekul
73,9 g/mol
Titik lebur
723 ºC
Penguraian
Terurai pada 1300 ºC.
Kepadatan
2.11 g/cm3
Kelarutan
Sedikit larut dalam air: 1,31 % berat pada 20 ºC. Kelarutan airnya berkurang seiring dengan meningkatnya suhu. Itu larut dalam asam encer. Itu tidak larut dalam alkohol dan aseton.
Dapat melayani Anda: barium oksida (BAO): struktur, sifat, penggunaan, risikoph
Solusi air adalah basa, mereka memiliki pH lebih besar dari 7.
Sifat kimia
Li2BERSAMA3 Itu dihidrolisis dalam larutan berair menghasilkan larutan dasar. Proporsi kecil senyawa yang dilarutkan dalam air meninggalkan karbonat anion bebas bebas32-.
Karbonat anion co32- Gratis dalam larutan berair membutuhkan proton untuk membentuk anion bikarbonat HCO3-, Seperti yang dapat dilihat dalam reaksi berikut:
BERSAMA32- + H2O → HCO3- + Oh-
Kehadiran ion OH- Inilah yang membuat solusinya mendasar.
Sifat biologis
Pada jaringan hewan dan manusia biasanya ada jejak lithium -ion, tetapi sampai saat tidak ada peran fisiologis alami dari ion ini yang diketahui.
Dalam organisme manusia LI2BERSAMA3 dicerna sebagai obat, bekerja pada berbagai mekanisme pensinyalan dalam neuron dan sel lainnya. Ini hasil dari penggantian kation seperti natrium dan kalium.
Penggabungan ion lithium ke dalam struktur membran sel dapat mengubah respons terhadap hormon dan kopling sel dengan proses energi.
Dengan cara ini lithium memodifikasi beberapa proses seluler termasuk metabolisme.
Melalui modifikasi cara sel bekerja2BERSAMA3 Anda dapat bertindak berdasarkan mekanisme komunikasi neuron di otak.
Memperoleh
Li2BERSAMA3 Dapat diperoleh dengan reaksi lithium hidroksida dengan karbon dioksida CO2, Seperti yang ditunjukkan di bawah ini:
2 lioh + co2 → Li2BERSAMA3 + H2SALAH SATU
Terjadi secara komersial dari mineral yang mengandung lithium seperti spodumen dan lepidolit. Mineral ini diobati pada suhu tinggi dengan garam sulfat tertentu atau dengan senyawa alkali untuk mendapatkan garam lithium.
Garam lithium yang diperoleh dimurnikan dengan larutan air atau asam dan kemudian diperlakukan dengan karbonat untuk membentuk LI2BERSAMA3.
Namun, LI2BERSAMA3 dicapai dengan cara ini terkontaminasi dengan sulfat atau kalsium klorida, magnesium, besi, natrium, kalium, dll. Jadi membutuhkan pemurnian selanjutnya.
Aplikasi
Dalam pengobatan penyakit mental
Ini digunakan sebagai agen antidepresan, antimaniac, dalam pengobatan perilaku agresif-impulsif dan untuk gangguan bipolar (orang yang mengubah humor mereka tiba-tiba tanpa sebab, menjadi kekerasan).
Dapat melayani Anda: 20 contoh sublimasi dan karakteristik kimia Beberapa gangguan agresif-impulsif dapat diobati dengan LI2BERSAMA3. Penulis: Prawny. Sumber: Pixabay.
Beberapa gangguan agresif-impulsif dapat diobati dengan LI2BERSAMA3. Penulis: Prawny. Sumber: Pixabay. Dokter telah mengamati bahwa administrasi mereka menyebabkan penurunan intensitas dan frekuensi periode depresi dan episode manik yang parah.
Ini digunakan sendiri, yaitu, tanpa senyawa tambahan, dalam terapi pemeliharaan depresi unipolar dan untuk gangguan skizoesifikal. Ini juga berfungsi untuk meningkatkan efek antidepresan dari obat lain.
Meskipun telah digunakan untuk mengobati anak -anak dengan gejala gangguan bipolar dan hiperaktif dengan komponen neurotik atau agresif, itu belum efektif dalam semua kasus.
Dalam pengobatan gejala penyakit lain
Ini digunakan untuk mengurangi frekuensi sakit kepala yang kuat, berulang dan kronis.
Ini digunakan untuk mengurangi insiden infeksi pada pasien dengan kemoterapi yang diinduksi neutropenia atau alasan lainnya. Neutropenia adalah penurunan neutrofil, sejenis sel darah putih yang membantu melawan infeksi dalam tubuh.
Ini telah digunakan sebagai penghambat enzim tiroid untuk pengobatan hipertiroidisme, tetapi tidak lebih disukai pengobatan karena efek sampingnya.
Bentuk administrasi
Ini digunakan dalam bentuk tablet atau kapsul Li2BERSAMA3. Juga di tablet Slow -Release dengan lithium citrate. Li lebih disukai2BERSAMA3 Karena tidak mengiritasi tenggorokan saat menelannya, seperti yang terjadi dengan garam lithium lainnya.
 Penulis: Pete Lyforth. Sumber: Pixabay.
Penulis: Pete Lyforth. Sumber: Pixabay. Dampak buruk
Li2BERSAMA3 Ini dapat memiliki efek berbahaya pada tiroid dan ginjal, sehingga fungsi organ -organ ini harus dipantau sebelum dan selama perawatan dengan senyawa ini.
Li2BERSAMA3 Ini bisa menjadi racun pada konsentrasi yang sangat dekat dengan yang digunakan dalam perawatan medis, jadi tinjauan terus menerus dari nilai serum darah mereka.
Gejala keracunan Li2BERSAMA3 Mereka adalah tremor, kejang otot, kelemahan otot, diare, muntah, kantuk atau ataksia (penurunan koordinasi otot), antara lain.
Di awal lirapy2BERSAMA3 Gejala seperti tremor, sakit kepala dan mual juga dapat terjadi. Tetapi ini cenderung menghilang dengan melanjutkan obat.
Dapat melayani Anda: HolmioSebagian besar orang yang dirawat juga dapat mengembangkan leukositosis (peningkatan jumlah sel darah putih), tetapi ini dapat dibalikkan.
Orang yang sedang diobati dengan Li2BERSAMA3 Mereka tidak boleh menangani kendaraan atau mengoperasikan mesin, karena mengurangi koordinasi fisik dan kemampuan untuk melakukan kegiatan yang perlu waspada.
Kasus yang tidak boleh dikelola
Seharusnya tidak digunakan pada anak -anak di bawah 12 tahun, karena dapat mengganggu pembentukan tulang dan kepadatannya, karena mengubah konsentrasi hormon tiroid. Itu juga cenderung menempati tempat kalsium di dalam tulang.
Mereka tidak boleh diperlakukan dengan li2BERSAMA3 Orang dengan penyakit kardiovaskular, ginjal atau tiroid. Juga tidak pada pasien yang mengalami dehidrasi parah.
Wanita hamil tidak boleh diberikan terutama selama trimester pertama kehamilan. Lithium melintasi plasenta dan dapat mencapai janin dengan mudah dengan kemungkinan efek teratogenik, yaitu, dapat menghasilkan anomali atau malformasi pada bayi yang sedang terjadi.
Orang tua yang membutuhkan perawatan dengan li2BERSAMA3 Mereka harus diperlakukan dengan sangat hati -hati dan dengan dosis yang lebih rendah dari pada orang dewasa muda, karena mereka dapat mengembangkan penyakit hipotiroidisme.
Penggunaan lainnya
Li2BERSAMA3 Kemurnian tinggi banyak digunakan dalam pembuatan baterai lithium.
Ini digunakan dalam sel bahan bakar karbonat cair.
Ini digunakan dalam pembuatan porselen listrik yang merupakan jenis listrik porselen isolasi. Ini juga digunakan dalam produksi kaca pada keramik.
 Li2BERSAMA3 Ini digunakan untuk membuat porselen listrik, yang digunakan sebagai isolator listrik, misalnya dalam tiang daya listrik. Fir0002 flagstoffotos [at] gmail.com canon 20d + tamron 28-75mm f/2.8 [gfdl 1.2 (http: // www.gnu.Org/lisensi/lisensi lama/FDL-1.2.html)]. Sumber: Wikimedia Commons.
Li2BERSAMA3 Ini digunakan untuk membuat porselen listrik, yang digunakan sebagai isolator listrik, misalnya dalam tiang daya listrik. Fir0002 flagstoffotos [at] gmail.com canon 20d + tamron 28-75mm f/2.8 [gfdl 1.2 (http: // www.gnu.Org/lisensi/lisensi lama/FDL-1.2.html)]. Sumber: Wikimedia Commons. Ini memungkinkan untuk menyiapkan keramik dengan koefisien ekspansi rendah, yaitu, itu mengembang sangat sedikit ketika meningkatkan suhu, sehingga keramik dapat digunakan dalam interval suhu yang lebih tinggi.
Penggunaannya yang lain adalah sebagai katalis, dalam pembuatan senyawa lithium lainnya, seperti elektroda pengelasan, dalam formula cat luminescent, pernis dan pewarna, serta dalam produksi elektrolitik aluminium.
Ini berguna untuk menghasilkan pengaturan semen yang lebih cepat dan menambah lem ubin sehingga mereka dapat diperbaiki dalam waktu singkat.
 Penulis: Capri23Auto. Sumber: Pixabay.
Penulis: Capri23Auto. Sumber: Pixabay. Referensi
- Cai, w. et al. (2018). Penghapusan SO42- dari li2BERSAMA3 dengan rekristalisasi di NA2BERSAMA3. Crystals 2018, 8, 19. MDPI pulih.com.
- Gadikota, g. (2017). Menghubungkan perubahan struktural morfologis dan kristal selama konversi lithium hidroksida monohidrat ke lithium karbonat menggunakan pengukuran hamburan sinar-X multi-skala. Mineral 2017, 7, 169. MDPI pulih.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Lithium karbonat. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Edisi keempat. John Wiley & Sons.
- Ensiklopedia Kimia Industri Ullmann. (1990). Edisi Kelima. Vch verlagsgellschaft mbh.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- « Contoh sudut terkonjugasi internal dan eksternal, latihan
- .Struktur Asam Stearat (CH3 (CH2) 16COOH), Properti, Penggunaan »

