Beban formal
- 1497
- 432
- Tommie Smith
Apa beban formal?
Itu Beban formal (CF) adalah salah satu yang ditugaskan ke atom molekul atau ion, yang memungkinkan untuk menjelaskan struktur dan sifat kimianya tergantung pada ini. Konsep ini menyiratkan pertimbangan karakter maksimum kovalensi dalam tautan A-B; yaitu, sepasang elektron dibagi secara merata antara A dan B.
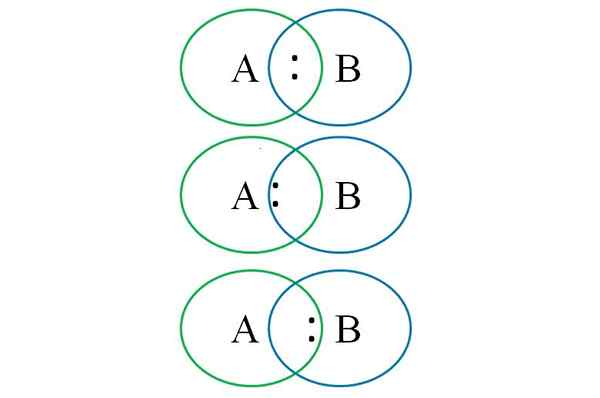
Untuk memahami hal di atas pada gambar bawah, dua atom tertaut ditampilkan: satu ditunjuk dengan huruf A dan yang lainnya dengan huruf b. Seperti yang dapat dilihat, dalam intersep lingkaran tautan dengan pasangan dibentuk ":". Dalam molekul heteronuklear ini, jika a dan b memiliki elektronegativitas yang sama dengan torsi ":" tetap sama dengan A dan B baik.

Namun, mengingat bahwa dua atom yang berbeda tidak dapat memiliki sifat yang sama, pasangan ":" tertarik yang lebih elektronegatif. Dalam hal ini, jika A lebih elektronegatif daripada B, pasangan ":" lebih dekat dengan b. Sebaliknya terjadi ketika B lebih elektronegatif daripada A, sekarang mendekat ":" A b.
Kemudian, untuk menetapkan muatan formal baik A dan B, perlu untuk mempertimbangkan kasus pertama (yang di atas gambar). Jika tautan kovalen murni A-B pecah, perpisahan homolitik akan terjadi, menghasilkan radikal bebas A · dan · b.
Manfaat kualitatif dari penggunaan beban formal
Elektron tidak diperbaiki, seperti pada contoh sebelumnya, tetapi mereka bepergian dan hilang oleh atom molekul atau ion. Jika itu adalah molekul diatomik, diketahui bahwa pasangan ":" harus dibagikan atau berkeliaran di antara kedua atom; Hal yang sama terjadi dalam molekul tipe A-B-C, tetapi dengan kompleksitas yang lebih besar.
Namun, ketika sebuah atom dipelajari dan mengasumsikan kovalensi seratus persen dalam hubungannya, lebih mudah untuk menetapkan apakah dalam senyawa menang atau kehilangan elektron. Untuk menentukan keuntungan atau kerugian ini, keadaan basal atau bebas Anda harus dibandingkan dengan lingkungan elektronik Anda.
Dapat melayani Anda: hukum amagat: penjelasan, contoh, latihanDengan cara ini, dimungkinkan untuk menetapkan beban positif (+) jika atom kehilangan elektron, atau beban negatif (-) ketika, sebaliknya, elektron menang (tanda-tanda harus ditulis di dalam lingkaran).
Dengan demikian, meskipun elektron tidak dapat ditempatkan persis, beban formal ini (+) dan (-) dalam struktur disesuaikan dalam banyak kasus dengan sifat kimia yang diharapkan.
Yaitu, beban formal atom terkait erat dengan geometri molekul lingkungan dan reaktivitasnya dalam senyawa.
Formula dan cara menghitungnya
Adalah beban formal yang ditetapkan secara sewenang -wenang? Jawabannya adalah tidak. Untuk ini, gain atau kehilangan elektron harus dihitung dengan mengasumsikan ikatan kovalen murni, dan ini dicapai melalui formula berikut:
CF = (Nomor Grup Atom) - (Jumlah tautan itu bentuk) - (Jumlah elektron yang tidak dikemas)
Jika atom memiliki CF dengan nilai +1, beban positif ( +) ditetapkan; Sedangkan jika Anda memiliki CF dengan nilai -1, itu kemudian ditetapkan beban negatif ( -).
Untuk menghitung CF dengan benar, langkah -langkah harus diikuti di bawah ini:
- Temukan grup mana yang merupakan atom dalam tabel periodik.
- Hitung jumlah tautan yang terbentuk dengan tetangga mereka: tautan ganda (=) bernilai dua dan triple link bernilai tiga (op).
- Akhirnya, menghitung jumlah elektron yang tidak dibagikan, yang dapat dengan mudah diamati dengan struktur Lewis.
Variasi perhitungan sesuai dengan struktur
Mengingat molekul linier A-B-C-D, beban formal untuk setiap atom dapat bervariasi jika struktur, misalnya, sekarang ditulis sebagai: B-C-A-D, C-A-B-D, A-C-D-B, dll. Ini karena ada atom yang, dengan berbagi lebih banyak elektron (membentuk lebih banyak ikatan), memperoleh CF positif atau negatif.
Itu dapat melayani Anda: meniskus (kimia)Jadi mana dari tiga struktur molekul yang mungkin sesuai dengan senyawa ABCD? Jawabannya adalah: yang umumnya memiliki nilai CF terendah; Juga, yang memberikan beban negatif (-) ke atom paling elektronegatif.
Jika C dan D lebih elektronegatif daripada A dan B, maka dengan berbagi lebih banyak elektron, mereka akibatnya memperoleh beban formal positif (terlihat dari aturan mnemonik).
Dengan demikian, struktur yang paling stabil, dan energi paling disukai, adalah c-a-b-d, karena di kedua c dan b mereka hanya membentuk satu tautan. Di sisi lain, struktur a-b-c-d dan yang memiliki c atau b membentuk dua tautan (-c- atau -d-), lebih tidak stabil.
Manakah dari semua struktur yang paling tidak stabil? A-c-d-b, karena tidak hanya c dan d membentuk dua tautan, tetapi juga beban formal negatifnya (-) berdekatan satu sama lain, semakin mengganggu struktur.
Contoh perhitungan beban formal
Bf4- (Ion tetrafluoroborato)
Atom boron dikelilingi oleh empat atom fluorin. Karena B milik Grup IIIA (13) tidak memiliki elektron yang tidak dibagikan dan membentuk empat ikatan kovalen, CF-nya adalah (3-4-0 = -1). Sebaliknya untuk f, elemen grup VIIA (17), CF-nya adalah (7-6-1 = 0).
Untuk menentukan beban ion atau molekul, itu cukup untuk menambahkan cf masing -masing atom yang menyusunnya: (1 (-1) + 4 (0) = -1).
Namun, CF untuk B tidak memiliki makna nyata; Ini, tentang ini tidak berada dalam kepadatan elektronik terbesar. Sebenarnya, kepadatan elektronik ini didistribusikan ke empat atom F, lebih banyak elemen elektronegatif daripada B.
Dapat melayani Anda: asam lemahBeh2 (beryllium hydride)
Atom berilium milik kelompok IIa (2), membentuk dua tautan dan kurang, sekali lagi, dari elektron yang tidak dibagikan. Dengan demikian, CF untuk BE dan H adalah:
CFMenjadi= 2-2-0 = 0
CFH= 1-1-0 = 0
LOAD BEKAT2= 1 (0) + 2 (0) = 0
CO (karbon monoksida)
Struktur Lewis -nya dapat direpresentasikan sebagai: cop: (meskipun menyajikan struktur resonansi lainnya). Mengulangi perhitungan CF, kali ini untuk C (dari kelompok PPN) dan O (dari grup via), Anda memiliki:
CFC= 4-3-2 = -1
CFSALAH SATU= 6-3-2 = +1
Ini adalah contoh di mana biaya formal tidak sesuai dengan sifat elemen. OR lebih elektronegatif daripada C dan, oleh karena itu, tidak boleh membawa positif.
Struktur lainnya (c = o dan (+BERSAMA(-)), meskipun mereka mematuhi alokasi koheren beban, mereka gagal untuk mematuhi aturan oktet (C memiliki kurang dari delapan elektron Valencia).
NH4+ (ion amonium), NH3 dan nh2- (Amiduro ion)
Semakin banyak elektron berbagi N, semakin positif CF -nya (ke ion amonium, karena tidak memiliki ketersediaan energi untuk membentuk lima obligasi).
Juga menerapkan perhitungan untuk n amonium, amonia dan ion amiduro, kemudian memiliki:
CF = 5-4-0 = +1 (NH4+)
CF = 5-3-2 = 0 (NH3)
Dan akhirnya:
CF = 5-2-4 = -1 (NH2-)
Yaitu, di NH2- N memiliki empat elektron yang tidak dibagikan, dan berbagi semua saat membentuk NH4+. CF untuk h sama dengan 0 dan, oleh karena itu, perhitungan Anda disimpan.

