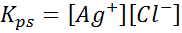Hukum tindakan massal

- 2965
- 43
- Joseph Nader PhD
 Reaksi curah hujan melibatkan keseimbangan kelarutan, yang diatur oleh undang -undang tindakan massal
Reaksi curah hujan melibatkan keseimbangan kelarutan, yang diatur oleh undang -undang tindakan massal Apa hukum tindakan massal?
Itu Hukum tindakan massal menyatakan bahwa kecepatan reaksi tergantung pada konsentrasi reaktan yang diangkat ke koefisien stoikiometriknya. Undang -undang ini memungkinkan untuk saling berhubungan satu sama lain konsentrasi dalam keseimbangan reaktan dan produk dari reaksi kimia reversibel. Dengan kata lain, ini menetapkan rumus konstanta kesetimbangan.
Undang -undang tindakan massal diucapkan oleh ahli kimia Norwegia (dan krim) Cato M. Guldberg (1836-1902) dan Peter Waage (1833-1900) pada tahun 1864. Ini adalah salah satu hukum fundamental kimia, karena memungkinkan kita untuk menghitung konsentrasi akhir dalam keseimbangan dari jumlah awal.
Selain itu, hukum massa juga memungkinkan kita untuk dengan mudah memahami efek dari perubahan konsentrasi spesies mana pun yang seimbang. Dengan kata lain, ini memungkinkan kita untuk memahami bagaimana prinsip Le Chatlier bekerja.
Meskipun disebut "hukum tindakan massal", itu tidak benar -benar merujuk pada massa reaktan dan produk, melainkan, lebih pada konsentrasi mereka. Alasan yang disebut hukum tindakan massal dan bukan hukum tindakan konsentrasi adalah karena konsentrasi dulu disebut "massa aktif".
Hukum tindakan massa dan konstanta keseimbangan
Menurut undang -undang tindakan massa, ketika reaksi yang dapat dibalik mencapai keseimbangan itu bukan karena reaksi berhenti. Sebaliknya, keseimbangan tercapai ketika kecepatan reaksi langsung dilakukan sama dengan kecepatan reaksi terbalik. Ketika itu terjadi, semua spesies kimia terjadi dan dikonsumsi pada kecepatan yang sama, sehingga konsentrasinya menjadi konstan (mereka berhenti berubah).
Dapat melayani Anda: toluena: struktur, sifat, penggunaan, mendapatkanGuldberg dan Waage menemukan bahwa kecepatan kedua reaksi (langsung dan terbalik) tergantung pada konsentrasi molar (dalam mol/L) pada reagen mereka meningkat ke koefisien stoikiometrik. Dari pengamatan ini mereka berhasil menemukan formula untuk konstanta keseimbangan.
Menurut undang -undang ini, untuk reaksi kimia reversibel yang mencapai keseimbangan,
“... Hubungan antara produk konsentrasi molar produk yang diangkat dengan koefisien stoikiometrik mereka dan produk konsentrasi molar reaktan yang diangkat ke koefisien stoikiometriknya konstan pada suhu tertentu."
Konstanta ini disebut "konstanta keseimbangan" dan diwakili dengan simbol KC.
Formula konstan kesetimbangan
Mari kita lihat bagaimana pernyataan sebelumnya dalam bentuk persamaan matematika. Ini adalah reaksi kimia reversibel seperti yang disajikan di bawah ini, di mana A dan B adalah reaktan, C dan D produk, dan A, B, C dan D adalah koefisien stoikiometrik masing -masing dari reaksi seimbang:
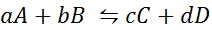
Untuk reaksi generik seperti ini, konstanta keseimbangan diberikan oleh:
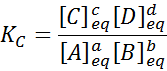
di mana [a], [b], [c] dan [d] adalah konsentrasi molar dari a, b, c dan d dalam keseimbangan.
Keseimbangan konstan dalam tekanan
Rumus sebelumnya untuk konstanta kesetimbangan berlaku untuk reaksi kimia di mana semua zat berada dalam fase yang sama (yaitu, semuanya dalam fase berair, atau dalam fase gas, misalnya). Namun, dalam kasus reaksi fase gas, lebih nyaman untuk bekerja dengan tekanan daripada dengan konsentrasi.
Karena konsentrasi gas molar sebanding dengan tekanan parsial mereka, maka formula konstanta kesetimbangan dapat ditulis ulang dalam hal tekanan ini, sebagai berikut:
Itu dapat melayani Anda: 30 penggunaan asam karboksilat dalam kehidupan sehari -hari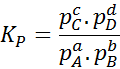
Dimana halKE, PB, PC Dan pD Mereka adalah tekanan parsial masing -masing A, B, C dan D, dan A, B, C dan D tetap menjadi koefisien stoikiometri. Dalam hal ini, kP Itu disebut keseimbangan konstan dalam tekanan, dan terkait dengan kC Melalui formula berikut:
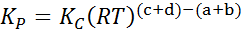
di mana r adalah konstanta universal gas ideal dan t adalah suhu absolut di kelvin.
Reaksi yang melibatkan lebih dari satu fase
Terkadang, reaksi kimia melibatkan pembentukan padatan sebagai endapan dari larutan, atau pembentukan cairan dari reaktan yang bereaksi dalam fase gas. Dalam kasus ini, reaksi tidak terjadi pada fase yang sama, jadi kita harus memodifikasi rumus konstan kesetimbangan.
Untungnya, modifikasi sangat sederhana. Satu -satunya hal yang harus kita perhitungkan saat menulis formula konstanta keseimbangan adalah bahwa zat murni yang muncul sebagai padatan atau cairan tidak boleh memperhitungkannya. Jika perlu, sebaliknya kami menempatkan 1.
Sebagai kesimpulan, undang -undang tindakan massa memungkinkan untuk menulis formula konstanta kesetimbangan baik dalam konsentrasi maupun dalam tekanan parsial. Setelah mengetahui salah satu dari keduanya, yang lain dapat ditemukan dari yang pertama.
Akhirnya, kita harus berhati -hati dan meninjau fase di mana semua spesies kimia ditemukan, untuk mengetahui apakah kita harus memasukkannya ke dalam konstanta kesetimbangan atau tidak.
Contoh Penggunaan Undang -Undang Tindakan Massal
Dalam contoh -contoh berikut kami menunjukkan cara menggunakan undang -undang tindakan massa untuk menulis rumus konstanta kesetimbangan untuk berbagai jenis reaksi kimia.
Reaksi reaksi dalam keadaan gas
Contoh 1: Dekomposisi N2SALAH SATU4 dalam fase gas
Kemudian2SALAH SATU4 Ini adalah gas coklat yang rusak sesuai dengan reaksi berikut:
Itu dapat melayani Anda: asam láurat: struktur, sifat, penggunaan, manfaat, efek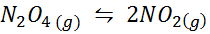
 Sampel NO2 pada suhu yang berbeda menunjukkan perpindahan keseimbangan ke Brown N2O4
Sampel NO2 pada suhu yang berbeda menunjukkan perpindahan keseimbangan ke Brown N2O4 Untuk reaksi ini, konstanta keseimbangan dalam konsentrasi dan tekanan diberikan oleh:
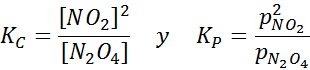
Contoh 2: Oksidasi karbon monoksida
Karbon monoksida adalah gas yang sangat beracun yang dapat menjadi karbon dioksida saat bereaksi dengan oksigen sesuai dengan reaksi berikut:
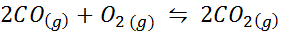
Untuk reaksi ini, konstanta keseimbangan dalam konsentrasi dan tekanan diberikan oleh:
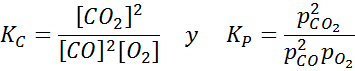
Keseimbangan asam-basa dalam fase berair
Contoh 3: self -length
Keseimbangan ionik air, juga dikenal sebagai reaksi panjang air, adalah reaksi reversibel antara dua molekul air dalam keadaan cair. Reaksinya adalah:
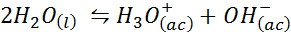
Saat menulis konstanta keseimbangan untuk reaksi ini, kita harus memperhitungkan bahwa, dalam hal ini, satu -satunya reagen adalah cairan murni yang konsentrasinya praktis konstan. Untuk alasan ini, itu tidak termasuk dalam rumus konstanta keseimbangan:
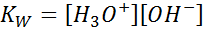
Ini adalah konstanta keseimbangan yang sangat penting yang menerima namanya sendiri (konstan produk ionik air) dan simbolnya sendiri (kW. W mengacu pada air dalam bahasa Inggris, yang dikatakan toilet). Namun, ini adalah konstanta keseimbangan dalam konsentrasi seperti yang lain.
Keseimbangan kelarutan
Contoh 4: Keseimbangan Kelarutan Klorida Perak
Ketika kami menyiapkan solusi jenuh, keseimbangan kelarutan ditetapkan. Dalam hal ini, keseimbangan adalah pembubaran perak klorida, yang reaksinya diberikan oleh:
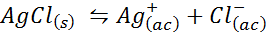
Konstanta keseimbangan dari reaksi ini (dan dari semua reaksi larutan) tidak termasuk perak klorida (AgCl) karena padat. Selain itu, seperti dalam kasus air, konstanta ini juga menerima nama khusus yang “konstan produk kelarutan”, diwakili sebagai k$: