Struktur asam nitro (HNO2), sifat, sintesis

- 1809
- 345
- Tommie Smith
Dia asam nitro Itu adalah asam anorganik yang lemah, yang formulanya kimianya hno2. Pada dasarnya dalam larutan berair dengan warna biru pucat. Ini sangat tidak stabil, dan dengan cepat dipecah menjadi oksida nitrat, tidak, dan dalam asam nitrat, INO3.
Biasanya dalam larutan berair dalam bentuk nitrit. Secara alami juga berasal dari atmosfer sebagai akibat dari reaksi nitrat oksida dengan air. Di sana, khususnya di troposfer, asam nitrat mengintervensi dalam regulasi konsentrasi ozon.
 Larutan asam nitrat dalam gelas kimia. Sumber: Tidak ada penulis yang dapat dibaca mesin yang disediakan. Ilmuwan gila ~ Commonswiki diasumsikan (berdasarkan klaim hak cipta). [Area publik]
Larutan asam nitrat dalam gelas kimia. Sumber: Tidak ada penulis yang dapat dibaca mesin yang disediakan. Ilmuwan gila ~ Commonswiki diasumsikan (berdasarkan klaim hak cipta). [Area publik] Pada gambar atas solusi HNO ditampilkan2 di mana karakteristik warna biru pucat asam ini dapat dilihat. Ini disintesis oleh pembubaran nitrogen trioksida, n2SALAH SATU3, Di dalam air. Demikian juga, ini adalah produk pengasaman larutan natrium nitrit pada suhu rendah.
Hno2 Ini memiliki sedikit penggunaan komersial, menggunakan dalam bentuk nitrit dalam konservasi daging. Di sisi lain, ini digunakan dalam elaborasi pewarna azoik.
Ini digunakan, bersama dengan natrium tiosulfat, dalam pengobatan pasien dengan keracunan natrium sianida. Tapi, itu adalah agen mutagenik, dan diperkirakan dapat menyebabkan substitusi pada basis rantai DNA, melalui deaminasi oksidatif sitosin dan adenin.
Asam nitro memiliki perilaku ganda, karena dapat berperilaku sebagai agen oksidatif atau sebagai agen pereduksi; yaitu, dapat dikurangi menjadi tidak atau n2, mengoksidasi3.
[TOC]
Struktur asam nitrat
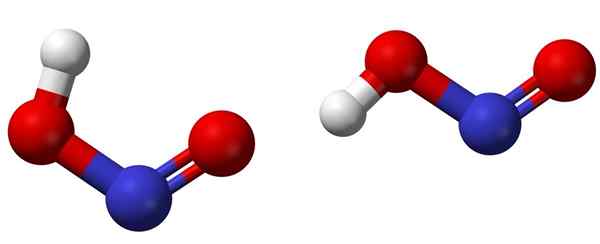 Isomer CIS (kiri) dan trans (kanan) dengan masing -masing struktur molekul HNO2. Sumber: Ben Mills [domain publik].
Isomer CIS (kiri) dan trans (kanan) dengan masing -masing struktur molekul HNO2. Sumber: Ben Mills [domain publik]. Gambar atas menunjukkan struktur molekul asam nitrat melalui model bola dan batang. Atom nitrogen (bola biru) terletak di tengah struktur, membentuk ikatan rangkap (n = O) dan yang sederhana (N-O) dengan atom oksigen (bola merah).
Perhatikan bahwa atom hidrogen (bola putih) terkait dengan salah satu oksigen dan tidak langsung ke nitrogen. Jadi, mengetahui hal ini, formula struktural HNO2 Itu [ho-n = o] atau [tidak (oh)], dan tidak ada tautan h-n seperti itu (seperti yang dapat dipikirkan oleh formula kimia).
Molekul gambar sesuai dengan fase gas; Di dalam air mereka dikelilingi oleh molekul air, yang dapat menerima ion hidrogen (lemah) untuk membentuk ion bukan2- dan H3SALAH SATU+.
Dapat melayani Anda: gelas kimiaStrukturnya dapat mengadopsi dua bentuk: cis atau trans, yang disebut isomer geometris. Dalam isomer cis, atom H dikecam dengan atom oksigen tetangga; Sedangkan di trans isomer, keduanya ditemukan pada posisi anti -opposite.
Dalam isomer CIS, pembentukan hidrogen intramolekul (OH-NO) kemungkinan, yang dapat mengimpor antarmolekul (OnOH-onOH).
Properti
Nama Kimia
-Asam nitro
-Asam Diokonitrat (III)
-Nitrosil hidroksida
-Hydroxideoxidonitrogen (nama sistematis IUPAC)
Deskripsi Fisik
Cairan biru pucat, sesuai dengan larutan nitrit.
Berat molekul
47.013 g/mol.
Konstan disosiasi
Itu adalah asam yang lemah. PKA -nya adalah 3,35 hingga 25 ºC.
Titik lebur
Hanya dikenal dalam solusi. Oleh karena itu, titik leleh Anda tidak dapat dihitung, kristal Anda juga tidak dapat diisolasi.
Titik didih
Dengan tidak ada murni tetapi dalam air, pengukuran properti ini tidak tepat. Di satu sisi, itu tergantung pada konsentrasi HNO2, Dan di sisi lain, pemanasannya menghasilkan dekomposisinya. Itulah mengapa titik didih yang tepat tidak dilaporkan.
Formasi Penjualan
Air larut -nitrit yang larut dengan Li+, Na+, K+, Ac2+, Tn2+, Ba2+. Tapi, jangan membentuk garam dengan kation serbaguna, seperti: ke3+ dan/atau menjadi2+ (karena kepadatan bebannya yang tinggi). Itu mampu membentuk ester yang stabil dengan alkohol.
Potensi kebakaran
Ini mudah terbakar untuk reaksi kimia. Dapat meledak melalui kontak dengan fosfor triklorida.
Penguraian
Ini adalah senyawa yang sangat tidak stabil, dan dalam larutan berair itu terurai dalam oksida nitrat dan asam nitrat:
2 hno2 => Tidak2 + Tidak +h2SALAH SATU
4 hno2 => 2 hno3 + N2Atau +h2SALAH SATU
Agen pereduksi
Asam nitrat dalam larutan berair disajikan dalam bentuk ion nitrit, NO2-, yang mengalami beberapa reaksi reduksi.
Bereaksi dengan ion i- dan iman2+, Dalam bentuk kalium nitrit, untuk membentuk nitrat oksida:
2 Kno2 + Ki +h2Sw4 => I2 + 2 Tidak +2 jam2Atau +k2Sw2
Kalium nitrit dengan adanya ion timah dikurangi untuk membentuk nitro oksida:
Kno2 + 6 hcl +2 sncl2 => 2 sncl4 + N2O +3 h2O +2 kcl
Dapat melayani Anda: beryl hydroxide (be (OH) 2)Kalium nitrit dikurangi oleh Zn dalam lingkungan alkali, membentuk amonia:
5 jam2O +Kno2 + 3 zn => nh3 + KOH +3 Zn (OH)2
Agen pengoksidasi
Selain menjadi zat pereduksi, asam nitrat dapat melakukan intervensi dalam proses oksidasi. Misalnya: teroksidasi menjadi hidrogen sulfida, menjadi nitrat atau amonia oksida, tergantung pada keasaman media di mana reaksi terjadi.
2 hno2 + H2S => s +2 no +2 h2SALAH SATU
Hno2 + 3 h2S => S +NH3 + 2 h2SALAH SATU
Asam nitrat, dalam media pH asam, dapat mengoksidasi ion iodida menjadi yodium.
Hno2 + yo- + 6 h+ => 3 i2 + NH3 + 2 h2SALAH SATU
Anda juga dapat bertindak sebagai agen pereduksi yang bertindak pada CU2+, menyebabkan asam nitrat.
Tata nama
Ke hno2 Anda dapat memberikan nama lain, yang tergantung pada jenis nomenklatur. Asam nitrat sesuai dengan nomenklatur tradisional; asam dioksiitrat (III), ke nomenklatur stok; dan dioxonitrate (III) hidrogen, ke sistematis.
Perpaduan
Asam nitrat dapat disintesis dengan melarutkan nitrogen trioksida dalam air:
N2SALAH SATU3 + H2O => 2 hno2
Metode persiapan lainnya adalah reaksi nitium nitrit, nano3, dengan asam mineral; seperti asam klorida dan asam bromisis. Reaksi dibuat pada suhu rendah dan asam nitrat dikonsumsi in situ.
Kakak3 + H+ => Hno2 + Na+
H+ Itu datang baik dari HCL atau HBR.
Risiko
Mengingat sifat dan karakteristik kimianya, ada sedikit informasi tentang efek toksik langsung dari HNO2. Mungkin beberapa efek berbahaya yang diyakini dihasilkan oleh senyawa ini, sebenarnya disebabkan oleh asam nitrat, yang dapat terjadi dengan membusuk asam nitrat.
Ditunjukkan bahwa hno2 Ini dapat memiliki efek berbahaya pada saluran udara dan dapat menghasilkan gejala iritasi pada pasien asma.
Dalam bentuk natrium nitrit, dikurangi oleh deoxyhemoglobin, menghasilkan nitrat oksida nitrat. Ini adalah vasodilator yang kuat yang menghasilkan relaksasi otot polos pembuluh darah, memperkirakan pada manusia dosis LD50 35 mg/kg untuk konsumsi oral.
Toksisitas natrium nitrit dimanifestasikan dengan keruntuhan kardiovaskular, diikuti oleh hipotensi parah, karena aksi vasodilator oksida nitrat, yang dihasilkan dari nitrit.
Nitrogen dioksida, tidak2, Hadir di udara yang terkontaminasi (kabut asap), dalam kondisi tertentu dapat menyebabkan asam nitrat; yang pada gilirannya dapat bereaksi dengan amina untuk membentuk nitrosamin, gamma senyawa karsinogenik.
Itu dapat melayani Anda: perak oksida (ag2o)Reaksi serupa terjadi dengan asap rokok. Residu nitrosamin yang dipatuhi lapisan interior kendaraan merokok telah ditemukan.
Aplikasi
Produksi Penjualan Diazonium
Asam nitrat digunakan dalam industri dalam produksi garam diazonium, melalui reaksinya dengan amina dan fenol aromatik.
Hno2 + Rnah2 + H+ => Rna = nar +h2SALAH SATU
Garam diazonium digunakan dalam reaksi sintesis organik; Misalnya, dalam reaksi Sandmeyer. Dalam reaksi ini penggantian kelompok amino terjadi (h2N-), dalam amina aromatik primer, oleh kelompok CL-, Br- dan cn-. Untuk mendapatkan produk aromatik ini, garam coucro diperlukan.
Garam Diazonium dapat membentuk senyawa atap yang brilian yang digunakan sebagai pewarna dan juga berfungsi sebagai uji kualitatif untuk mendeteksi keberadaan amina aromatik.
Eliminasi Sodium Azida
Asam nitrat digunakan untuk menghilangkan natrium azid3), yang berpotensi berbahaya karena kecenderungannya untuk mengeksploitasi.
2 nan3 + 2 hno2 => 3 n2 + 2 Tidak +2 NaOH
Sintesis oksimas
Asam nitrat dapat bereaksi dengan gugus keton untuk membentuk oksimas. Ini dapat dioksidasi untuk membentuk karboksil atau mengurangi asam untuk menyebabkan amina.
Proses ini digunakan dalam persiapan komersial asam adipat, monomer yang digunakan dalam produksi nilon. Ini juga campur tangan dalam produksi poliuretan dan esternya adalah plasticizer, terutama di PVC.
Di bawah bentuk garamnya
Asam nitrat, dalam bentuk natrium nitrit, digunakan dalam perawatan dan konservasi daging; Karena, itu mencegah pertumbuhan bakteri dan mampu bereaksi dengan mioglobin, menghasilkan warna merah gelap yang membuat daging lebih menarik untuk dikonsumsi.
Garam yang sama ini digunakan, bersama dengan natrium tiosulfat, dalam perlakuan intravena keracunan natrium sianida.
Referensi
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (10th Edisi.). Wiley Plus.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Pubchem. (2019). Asam nitro. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Softschools. (2019). Asam nitro. Pulih dari: softschools.com
- Wikipedia. (2019). Asam nitro. Diperoleh dari: di.Wikipedia.org
- Royal Society of Chemistry. (2015). Asam nitro. Pulih dari: chemspider.com
- Ensiklopedia Dunia Baru. (2015). Asam nitro. Pulih dari: newworldyclopedia.org
- CHANKBANK. (2019). Asam nitro. Pulih dari: bankbank.Ac
- Formulasi Kimia. (2018). Hno2. Pulih dari: formulasi quimica.com
- « Angka atau indikator yang berbicara tentang kemajuan pendidikan di suatu negara
- Sifat alkil halogenuros, mendapatkan, contoh »

