Struktur seng klorida (zncl2), properti, memperoleh, penggunaan

- 4436
- 119
- Herbert Fritsch
Dia seng klorida Ini adalah senyawa anorganik yang dibentuk oleh elemen seng atau seng (Zn) dan klorin (CL). Formula kimianya adalah Zncl2. CINC ditemukan dalam keadaan oksidasi +2 dan klorin memiliki valencia -1.
Itu adalah padatan kristal putih yang tidak berwarna atau putih. Ini sangat larut dalam air dan dengan mudah menyerapnya dari lingkungan, yang dapat dilihat pada gambar padatan yang dibasahi di bawah ini.
 Fifcl chloride2 padat agak terhidrasi. Pengguna: walkerma / domain publik. Sumber: Wikimedia Commons.
Fifcl chloride2 padat agak terhidrasi. Pengguna: walkerma / domain publik. Sumber: Wikimedia Commons. Seng dari senyawa ini secara biologis sangat penting bagi manusia, hewan dan tumbuhan, karena mengintervensi fungsi dasar seperti protein dan sintesis lemak.
Untuk alasan ini ZNCL2 Ini digunakan sebagai pelengkap nutrisi untuk hewan dan manusia dalam kasus kekurangan seng, dan sebagai mikronutrien untuk tanaman.
Ini memiliki sifat bakteriostatik dan astringen, dan banyak digunakan untuk tujuan ini dalam kedokteran manusia dan hewan. Juga menghilangkan hama seperti jamur luar ruangan dan perantara untuk mendapatkan pestisida.
Di antara kegunaannya, ia berfungsi untuk mengobati serat selulosa dan wol dalam berbagai proses, serta menyiapkannya untuk warna atau pencetakan. Tunda juga pembakaran kayu.
[TOC]
Struktur
Zncl2 Itu adalah senyawa ionik yang dibentuk oleh kation zn2+ dan dua anion klorida CL- yang mengikat melalui gaya elektrostatik.
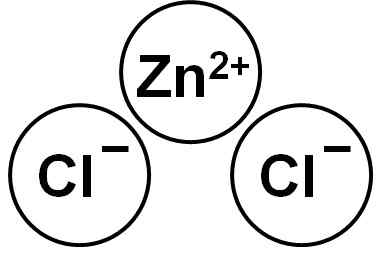 Seng klorida. Penulis: Marilú Stea.
Seng klorida. Penulis: Marilú Stea. Ion seng (II) memiliki struktur elektronik berikut:
1s2, 2s2 2 p6, 3S2 3p6 3d10, 4s0,
di mana diamati bahwa kedua elektron jubah 4s, dimana konfigurasinya stabil.
Ion klorida menyajikan struktur berikut:
1s2, 2s2, 2 p6, 3S2 3p6,
yang juga sangat stabil untuk memiliki orbital lengkap.
Pada gambar, cara ion yang tersedia dalam kaca dapat diamati. Bola abu -abu mewakili bola seng dan hijau ke klorin.
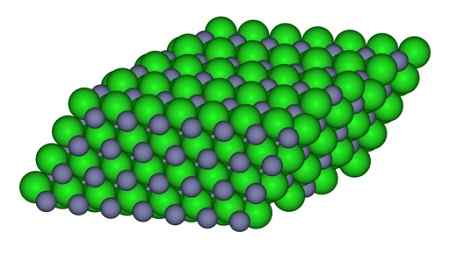 Struktur yang membentuk ion dalam kristal ZnCl2. CCOIL/CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons.
Struktur yang membentuk ion dalam kristal ZnCl2. CCOIL/CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons. Tata nama
- Seng klorida (II)
- Seng Dichloride
Properti
Keadaan fisik
Solid tidak berwarna atau putih kristal. Kristal Heksagonal.
Berat molekul
136.3 g/mol
Titik lebur
290 ºC
Titik didih
732 ºC
Kepadatan
2.907 g/cm3 pada 25 ° C
Kelarutan
Sangat larut dalam air: 432 g/100 g h2Atau pada 25 ° C, 614 g/100 g h2Atau 100 ° C. Sangat larut dalam asam klorida (HCl), alkohol dan gliserol. Benar -benar larut.
Dapat melayani Anda: Merkurius Hydroxide: Struktur, Properti, Penggunaan, Risikoph
Solusi berairnya bersifat asam. Larutan 6 mol ZnCl2/L memiliki pH 1,0.
Sifat kimia
Ini adalah senyawa higroskopis dan lezat, karena bersentuhan dengan kelembaban lingkungan yang menyerap banyak air. Di dalam air dihidrolisis dan memiliki kecenderungan untuk membentuk dasar yang tidak larut dari seng oksychloride.
Bereaksi dengan seng oksida (ZnO) dalam air menghasilkan seng oksychlorides yang merupakan bahan semen tipe yang sangat keras.
Ini dengan lembut korosif terhadap logam.
Itu tidak mudah terbakar.
Peran biologis
Seng biologis adalah salah satu elemen terpenting. Itu telah diakui sebagai hal yang penting untuk semua cara hidup.
Di dalam tubuh manusia ZnCl2 Zn menyediakan, yang penting untuk protein, kolesterol dan sintesis lemak. Khususnya cinc penting untuk berfungsinya sistem kekebalan tubuh yang tepat.
 Zinc zncl2 Penting untuk pembelahan sel dalam makhluk hidup. Ladyofhats / domain publik. Sumber: Wikimedia Commons.
Zinc zncl2 Penting untuk pembelahan sel dalam makhluk hidup. Ladyofhats / domain publik. Sumber: Wikimedia Commons. Lebih dari 25 protein yang mengandung seng telah diidentifikasi, dan banyak di antaranya adalah enzim, diperlukan dalam pembelahan dan pertumbuhan sel, dan untuk pelepasan vitamin A dari hati.
Kekurangan CINC dapat menyebabkan pertumbuhan pertumbuhan, fungsi mental depresi, anoreksia, dermatitis, penurunan kekebalan, diare dan penglihatan malam yang buruk, di antara kondisi lainnya.
Memperoleh
Secara komersial senyawa ini dibuat dengan bereaksi asam klorida berair dengan memo, limbah seng atau dengan mineral yang mengandungnya. Dalam reaksi ini ada juga hidrogen gas (h2).
Mengobati seng dengan hidrogen klorida pada 700 ° C diperoleh.
Zn + hcl → zncl2 + H2↑
Aplikasi
Dalam perawatan terapeutik
Ini adalah antibakteri lunak atau bakteriostatik, sehingga digunakan dalam hujan vagina untuk menghilangkan infeksi tricomonas atau haemophilus. Ini juga berfungsi untuk mengobati kapalan, sebagai astringen dan di chemiocirugia pada kanker kulit.
Ini digunakan sebagai astringen dalam beberapa kosmetik seperti lotion yang menyegarkan untuk kulit.
Sebagai suplemen nutrisi
Karena pentingnya dalam berbagai fungsi organisme manusia ZnCl2 Itu diberikan secara oral sebagai bagian dari aksesori nutrisi dan juga pada orang yang membutuhkan makanan parenteral.
Suplemen ZnCl2 Mereka dipasok untuk mengobati zona.
Dapat melayani Anda: campuran homogen Suplemen ZnCl2 Mereka harus digunakan saat ada kekurangan seng. Penulis: Moakets. Sumber: Pixabay.
Suplemen ZnCl2 Mereka harus digunakan saat ada kekurangan seng. Penulis: Moakets. Sumber: Pixabay. Orang sehat mendapatkannya melalui makanan.
Itu harus disediakan setidaknya 1 jam sebelum makan atau 2 jam setelah ini, karena beberapa makanan dapat mencegah penyerapannya. Pada pasien yang mengalami iritasi lambung setelah konsumsi suplemen harus menelannya dengan makanan, tetapi dengan cara ini seng akan lebih sedikit biodispononable.
Dalam aplikasi hewan
Solusinya telah digunakan pada hewan sebagai agen kaustik untuk membakar atau fistula caulbody, yang merupakan koneksi antara organ yang tidak normal atau sehat; Dalam bentuk pasta berfungsi untuk mengobati borok dan kemoterapi kanker.
 Solusi berair ZnCl2 Mereka digunakan untuk mengobati infeksi mata binatang. Penulis: Mabel Amber. Sumber: Pixabay.
Solusi berair ZnCl2 Mereka digunakan untuk mengobati infeksi mata binatang. Penulis: Mabel Amber. Sumber: Pixabay. Dalam infeksi mata, larutan senyawa yang sangat encer bertindak sebagai antiseptik dan astringen.
Ini juga digunakan sebagai jejak dalam pakan ternak atau sebagai suplemen makanan.
Di semen khusus
Reaksi antara zncl2 Dan ZnO dalam air menghasilkan beberapa seng oksychloride yang membentuk bahan yang sangat keras atau semen. Konstituen utama adalah 4Zno • Zncl2• 5H2O dan zno • zncl2• 2H2SALAH SATU.
Jenis semen ini menolak serangan asam atau air mendidih. Namun, pentahidrat sangat stabil dan tidak larut tetapi tidak berubah, dan dihidrat lebih larut dan dapat menyebabkan drainase cair.
Karena alasan ini semen ini memiliki beberapa aplikasi.
Sebagai katalis
Itu berfungsi untuk mempercepat beberapa reaksi kimia organik. Bertindak sebagai agen kondensor. Misalnya, dalam reaksi aldolik, reaksi aminasi dan reaksi penambahan siklus. Dalam beberapa dari ini bertindak sebagai inisiator radikal.
Ini adalah asam Lewis dan mengkatalisasi reaksi diels-alder. Ini juga digunakan sebagai katalis dalam reaksi Friedel-Crafts, untuk memproduksi pewarna dan pewarna, dan dalam pembuatan resin poliester-politik.
Di bawah ini adalah reaksi di mana senyawa ini mengintervensi:
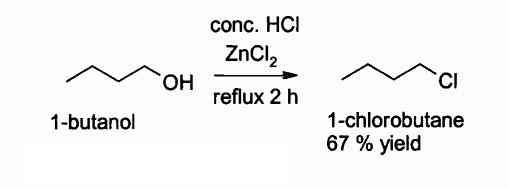 Reaksi mendapatkan alkil klorida menggunakan ZnCl2. Penulis: Walkerma. Sumber: Wikimedia Commons.
Reaksi mendapatkan alkil klorida menggunakan ZnCl2. Penulis: Walkerma. Sumber: Wikimedia Commons. Dalam kegiatan pertanian
Ini telah digunakan sebagai herbisida pada tanaman, sebagai perlakuan daun, untuk menghilangkan hama seperti jamur dan lumut, dan sebagai mikronutrien. Itu adalah perantara untuk menyiapkan pestisida.
Dalam aplikasi gigi
Ini digunakan dalam pencucian mulut, namun waktu kontak yang disarankan sangat singkat, jadi hanya bertindak sebagai astringen di mukosa oral. Ini berfungsi sebagai desensitizer, digunakan dalam pasta denifrik dan merupakan bagian dari semen gigi.
Dapat melayani Anda: natrium klorit (naClo2): struktur, sifat, penggunaan, risikoDi industri tekstil dan kertas
Ini adalah bahan pelarut yang digunakan dalam pembuatan rayon atau sutra buatan dari selulosa. Ini adalah retikulasi atau agen serikat untuk resin yang diselesaikan pada tekstil. Itu juga berfungsi untuk memperlakukan mereka dan mendukung konservasi mereka.
Ini memungkinkan untuk melengkung kain, memisahkan serat sutra dan wol, dan bertindak sebagai mordan dalam pencetakan dan pewarnaan tekstil.
Ini digunakan dalam pembuatan gulungan kertas dan untuk memproduksi kertas crepe.
Dalam persiapan nanopartikel
Dengan bereaksi seng klorida dengan natrium sulfida (NA2S) melalui metode sonokimia dan dengan adanya senyawa organik tertentu nanopartikel seng sulfida (Zns) diperoleh. Metode sonokimia menggunakan gelombang suara untuk menyebabkan reaksi kimia.
Jenis nanomaterial ini dapat memiliki aplikasi sebagai agen fotokatalitik untuk menghasilkan, misalnya, pembagian air dalam komponennya (hidrogen dan oksigen) dengan aksi cahaya.
Dalam beberapa aplikasi
- Deodoran, antiseptik dan desinfektan daerah. Kontrol lumut, jamur dan jamur di struktur dan area yang berdekatan dengan eksterior seperti trotoar, halaman dan pagar. Desinfektan toilet, kemih, karpet dan kayu terkompresi.
- Digunakan dalam campuran untuk empalmar dan solusi untuk konservasi spesimen anatomi.
- Retarder Api Kayu.
- Bahan utama dalam pompa asap yang digunakan untuk membubarkan banyak orang; Petugas pemadam kebakaran menggunakannya dalam latihan dan praktik pemadam kebakaran.
 Cinc Chloride digunakan dalam pompa asap yang digunakan dalam latihan militer. ATAU.S. Departemen Pertahanan Photoscpl Saat Ini. Abraham Lopez / Divisi Kelautan ke -2 / Domain Publik. Sumber: Wikimedia Commons.
Cinc Chloride digunakan dalam pompa asap yang digunakan dalam latihan militer. ATAU.S. Departemen Pertahanan Photoscpl Saat Ini. Abraham Lopez / Divisi Kelautan ke -2 / Domain Publik. Sumber: Wikimedia Commons. - Komponen aliran pengelasan. Dalam perekaman logam. Untuk pewarnaan baja, galvanis dan komponen kamar mandi veneer besi dengan tembaga.
- Di semen semen magnesium dan logam.
- Untuk memecahkan emulsi dalam pemurnian minyak. Agen dalam pembuatan aspal.
- Elektrolit dalam baterai kering.
 Baterai ZnCl kering2. Pengguna: 32bitmaschine; Diedit oleh pengguna Jaybear/CC BYS-S (https: // CreateVecommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons.
Baterai ZnCl kering2. Pengguna: 32bitmaschine; Diedit oleh pengguna Jaybear/CC BYS-S (https: // CreateVecommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons. - Vulkanisasi karet.
- Agen dehidrasi.
Risiko
Itu dapat menyebabkan luka bakar pada mata, kulit dan selaput lendir.
Saat dipanaskan hingga dekomposisinya memancarkan hidrogen klorida beracun (HCl) dan seng oksida (ZnO).
Memperingatkan tentang penggunaannya sebagai obat
Meskipun studi konklusif hilang, diperkirakan bahwa jika senyawa ini diberikan kepada wanita hamil, itu dapat menyebabkan kerusakan pada janin. Tetapi manfaat potensial bisa memiliki bobot lebih dari kemungkinan risiko.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Seng klorida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Liska, m. et al. (2019). Semen khusus. Semen seng oksychloride. Dalam Kimia Semen dan Beton Lea (Edisi Kelima). Pulih dari scientedirect.
- Pohaniish, r.P. (2017). Seng klorida. Dalam Buku Pegangan Sittig tentang bahan kimia dan carcinagens yang beracun dan berbahaya (edisi ketujuh). Pulih dari scientedirect.com.
- Gedanken, a. dan Perelshtein, I. (2015). USG daya untuk produksi nanomaterial. Dalam kekuatan ultrasonik. Pulih dari scientedirect.
- Archibald, s.J. (2003). Kelompok Logam Transisi 9-12. Reaksi dan katalisis. Dalam Memahami Koordinasi Kimia II. Pulih dari scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Timah, d.R. (Editor) (2003). Buku Pegangan Kimia dan Fisika CRC. 85th CRC Press.
- « Struktur kromat seng, sifat, memperoleh, menggunakan
- Struktur seng nitrat, sifat, memperoleh, menggunakan »

