Struktur seng nitrat, sifat, memperoleh, menggunakan

- 4506
- 1315
- Domingo Gutkowski
Dia seng nitrat Ini adalah senyawa anorganik yang dibentuk oleh elemen seng (Zn), nitrogen (N) dan oksigen (O) (O). Status oksidasi seng adalah +2, yaitu nitrogen adalah +5, dan oksigen adalah -2.
Formula kimianya adalah Zn (tidak3)2. Ini adalah kristal tidak berwarna padat yang cenderung menyerap air dari lingkungan. Dapat diperoleh dengan mengolah logam seng dengan asam nitrat encer. Itu adalah senyawa yang sangat mengoksidasi.
 Fifr zn nitrat (tidak3)2. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons.
Fifr zn nitrat (tidak3)2. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons. Ini berfungsi sebagai akselerator reaksi kimia organik dan memungkinkan Anda untuk mendapatkan polimer senyawa dengan sifat penggerak listrik. Itu digunakan untuk membentuk lapisan bahan yang berguna dalam elektronik.
Ini adalah bagian dari beberapa pupuk cair dan herbisida pelepasan lambat tertentu. Membantu dalam persiapan oksida kompleks yang meningkatkan kepadatan dan konduktivitas listrik Anda.
Ini telah berhasil diuji dalam memperoleh struktur yang berfungsi sebagai dasar untuk regenerasi dan pertumbuhan jaringan tulang, meningkatkan proses ini dan menghasilkan antibakteri.
Meskipun bukan bahan bakar, ia dapat mempercepat pembakaran zat yang ada, seperti batubara atau bahan organik. Ini adalah kulit yang menjengkelkan, mata, dan selaput lendir, dan sangat beracun bagi kehidupan air.
[TOC]
Struktur
Seng nitrat adalah senyawa ionik. Ini memiliki kation bivalen (Zn2+) dan dua anion monovalen (tidak3-). Anion nitrat adalah ion poliiatomik yang dibentuk oleh atom nitrogen dalam keadaan oksidasi +5 yang melekat pada tiga atom oksigen dengan valencia dari -2.
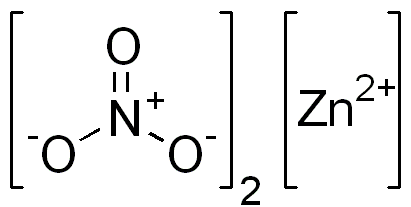 Struktur nitrat ionik seng. Domain edgar181 / pub. Sumber: Wikimedia Commons.
Struktur nitrat ionik seng. Domain edgar181 / pub. Sumber: Wikimedia Commons. Gambar di bawah ini menunjukkan struktur spasial senyawa ini. Bola pusat abu -abu adalah seng, bola biru adalah nitrogen dan bola merah mewakili oksigen.
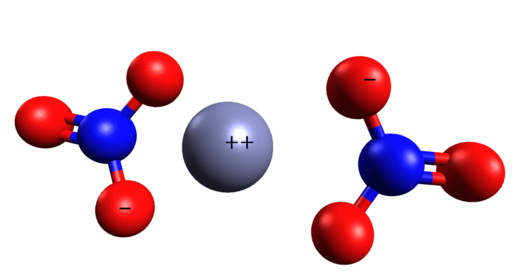 Struktur spasial Zn (tidak3)2. Cinc berada di tengah ion nitrat. Grasso Luigi/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Struktur spasial Zn (tidak3)2. Cinc berada di tengah ion nitrat. Grasso Luigi/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Tata nama
- Cinc Nitrate
- Seng Dinitrate
Properti
Keadaan fisik
Solid tidak berwarna atau putih kristal.
Berat molekul
189.40 g/mol
Titik lebur
Sekitar 110 ºC.
Itu dapat melayani Anda: asam iarhydric (hai): struktur, sifat dan penggunaanTitik didih
Sekitar 125 ºC.
Kepadatan
2.065 g/cm3
Kelarutan
Soluble Air: 120 g/100 g H2Atau pada 25 ° C. Alkohol larut.
ph
Solusi berairnya bersifat asam. Solusi 5% memiliki pH sekitar 5.
Sifat kimia
Untuk menjadi nitrat senyawa ini adalah oksidan yang kuat. Bereaksi keras dengan batubara, tembaga, logam sulfida, bahan organik, fosfor dan belerang. Jika disemprotkan pada eksploitasi batubara panas.
Di sisi lain, higroskopis dan menyerap air dari lingkungan. Jika seng oksida terbentuk, nitrogen dan oksigen dioksida:
2 Zn (Tidak3)2 + Panas → 2 Zno + 4 Tidak2↑ + o2↑
Dalam larutan alkali, seperti NaOH, seng dari senyawa ini membentuk hidroksida dan spesies kompleks lainnya:
Zn (tidak3)2 + 2 Oh- → Zn (OH)2 + 2 tidak3-
Zn (oh)2 + 2 Oh- → [Zn (OH)4]2-
Memperoleh
Dapat diperoleh dengan mengobati seng atau seng oksida dengan asam nitrat encer. Gas hidrogen terbentuk dalam reaksi ini.
Zn + 2 hno3 → Zn (Tidak3)2 + H2↑
Aplikasi
Katalisis Reaksi
Ini digunakan sebagai katalis dalam mendapatkan senyawa kimia lainnya seperti resin dan polimer. Ini adalah katalis asam.
 Contoh resin. Bugman di Wikipedia Inggris / Domain Publik. Sumber: Wikimedia Commons.
Contoh resin. Bugman di Wikipedia Inggris / Domain Publik. Sumber: Wikimedia Commons.  Model Struktur Polimer. Domain ilmari karonen / pub. Sumber: Wikimedia Commons.
Model Struktur Polimer. Domain ilmari karonen / pub. Sumber: Wikimedia Commons. Kasus percepatan reaksi lain adalah sistem katalitik Zn (no3)2/Voc2SALAH SATU4, yang memungkinkan oksidasi α-hidrolister menjadi stres α-zo dengan konversi 99% bahkan pada tekanan dan suhu lingkungan.
Dalam polimer senyawa
Film polymethylmetacrylate dan zn telah dikembangkan (tidak3)2 dengan sifat konduktivitas listrik yang menjadikannya kandidat yang tepat untuk digunakan dalam supercauge dan komputer berkecepatan tinggi.
Di semen oxyst
Dengan larutan seng nitrat berair dan bubuk seng oksida, bahan milik kelas semen yang dihasilkan oleh reaksi asam-basa diperoleh.
Ini memiliki resistensi yang masuk akal untuk larut dalam asam dan alkali yang diencerkan, mengembangkan kompresi resistensi kompresi dibandingkan dengan semen lainnya.
Properti ini meningkat ketika rasio ZnO/Zn meningkat (tidak3)2, Dan ketika konsentrasi Zn diunggah (tidak3)2 Dalam solusi. Semen yang diperoleh benar -benar amorf, yaitu, mereka tidak memiliki kristal.
Dapat melayani Anda: curah hujan kimia Dengan seng nitrat, tes untuk mendapatkan semen telah dilakukan. Penulis: Kobthanapong. Sumber: Pixabay.
Dengan seng nitrat, tes untuk mendapatkan semen telah dilakukan. Penulis: Kobthanapong. Sumber: Pixabay. Dalam pelapis dan nanomaterial seng oksida
Zn (tidak3)2 Ini digunakan untuk pengendapan elektrolitik lapisan seng oksida (ZnO) yang sangat tipis pada berbagai substrat. Struktur nano oksida ini juga disiapkan di permukaan.
 Nanopartikel seng oksida. Beberapa struktur nano ZnO dapat disiapkan dengan Zn (tidak3)2. Verena Wilhelmi, Ute Fischer, Heike Weildt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC oleh (https: // createveCommons.Org/lisensi/oleh/2.5). Sumber: Wikimedia Commons.
Nanopartikel seng oksida. Beberapa struktur nano ZnO dapat disiapkan dengan Zn (tidak3)2. Verena Wilhelmi, Ute Fischer, Heike Weildt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC oleh (https: // createveCommons.Org/lisensi/oleh/2.5). Sumber: Wikimedia Commons. ZnO adalah bahan yang sangat menarik karena banyak aplikasi di bidang optolektronik, ia juga memiliki sifat semikonduktor dan digunakan dalam sensor dan transduser.
Dalam herbisida
Cinc nitrat telah digunakan bersama dengan beberapa senyawa organik untuk mengurangi kecepatan pelepasan herbisida tertentu dalam air. Rilis lambat produk ini memungkinkan mereka tersedia untuk aplikasi yang lebih lama dan lebih sedikit.
Di manufaktur anod
Merangsang proses sintering dan meningkatkan kepadatan oksida tertentu yang berfungsi membuat anod untuk sel bahan bakar. Sintering memperoleh bahan padat melalui pemanasan dan kompresi bubuk tanpa mencapai mergernya.
 Menggambar bagaimana dua biji -bijian sintering terjadi. Zn (tidak3)2 Membantu dalam pelaksanaan proses ini pada beberapa oksida kompleks. Domain cdang / pub. Sumber: Wikimedia Commons.
Menggambar bagaimana dua biji -bijian sintering terjadi. Zn (tidak3)2 Membantu dalam pelaksanaan proses ini pada beberapa oksida kompleks. Domain cdang / pub. Sumber: Wikimedia Commons. Bahan -bahan di mana tes telah dilakukan adalah oksida kompleks strontium, iridium, besi dan titanium. Kehadiran Fal secara signifikan meningkatkan konduktivitas listrik dari ini.
Aplikasi lain
Itu digunakan dalam mendapatkan obat. Itu bertindak sebagai mordan dalam penerapan tinta dan pewarna. Berfungsi sebagai koagulan lateks. Ini adalah sumber seng dan nitrogen dalam pupuk cair.
Penggunaan potensial dalam rekayasa jaringan tulang
Senyawa ini telah digunakan sebagai aditif dalam elaborasi baju besi atau bingkai untuk regenerasi serat tulang, karena memungkinkan untuk meningkatkan resistensi mekanik dari struktur ini.
Dapat melayani Anda: Germanio: Sejarah, Properti, Struktur, Perolehan, PenggunaanTelah diamati bahwa perancah yang mengandung fift tidak beracun bagi sel osteoprogenitor, mendukung aktivitas osteoblas yang merupakan sel yang memproduksi tulang dan meningkatkan adhesi dan proliferasi mereka.
Mendukung pembentukan Apatita yang merupakan mineral yang membentuk tulang dan juga memberikan efek antibakteri.
 Zn (tidak3)2 Ini bisa sangat berguna untuk rekonstruksi materi tulang pada orang yang menderita kecelakaan. Mariano Coretti/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Zn (tidak3)2 Ini bisa sangat berguna untuk rekonstruksi materi tulang pada orang yang menderita kecelakaan. Mariano Coretti/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Risiko
Ini adalah bahan dengan risiko kebakaran dan ledakan potensial.
Itu bukan bahan bakar tetapi mempercepat pembakaran bahan yang mudah terbakar. Jika sejumlah besar senyawa ini terlibat dalam kebakaran atau jika bahan yang mudah terbakar dibagi dengan halus, ledakan dapat terjadi.
Saat mengalami panas yang kuat, nitrogen oksida beracun diproduksi. Dan jika paparan dilakukan berkepanjangan, itu bisa meledak.
Ini mengiritasi kulit, dapat menyebabkan kerusakan serius pada mata, iritasi pada saluran pernapasan, itu beracun karena konsumsi dan menyebabkan kerusakan pada saluran pencernaan.
Sangat beracun untuk kehidupan akuatik dengan efek yang bertahan.
Referensi
- Ju, dan. et al. (2019). Efek baru seng nitrat/vanadil oksalat untuk oksidasi katalitik selektif ester alfa-hidroksi menjadi alfa-keto eser dengan oksigen molekuler: an in situ in situ. Molekul 2019, 24, 1281. MDPI pulih.com.
- Mohd s., S.N. et al. (2020). Formulasi pelepasan terkontrol seng hidroksida nitrat yang diselingi dengan natrium dodecylsulphe dan anion bispyribac: novel nanokomposit herbisida untuk budidaya padi. Jurnal Kimia Arab 13, 4513-4527 (2020). Pulih dari scientedirect.
- Man, m.P. et al. (2019). Kekuatan mekanik yang diperkaya dan mineralisasi tulang dari perancah biomimetik electrospun sarat dengan oli ylang ylang dan seng nitrat untuk rekayasa jaringan tulang. Polimer 2019, 11, 1323. MDPI pulih.com.
- Kim, k.yo. et al. (2018). Efek seng nitrat sebagai bantuan sintering pada karakteristik elektokimia SR0.92DAN0,08Paman3-Delta dan MR0.92DAN0,08Anda0.6Keyakinan0.4SALAH SATU3-Delta Ceramics International, 44 (4): 4262-4270 (2018). Pulih dari scientedirect.com.
- Prasad, b.DAN. et al. (2012). Elektrodeposisi lapisan ZnO dari Zn berair (tidak3)2 Baths: Efek konsentrasi Zn, deposisi suhu, dan waktu pada orientasi. J Solid State Electochem 16, 3715-3722 (2012). Tautan pulih.Peloncat.com.
- Bahadur, h. dan srivastava, untuk.K. (2007). Morfologi film tipis deried sol-gel ZnO menggunakan bahan prekursor yang berbeda dan struktur nano mereka. Nanoscale Res Lett (2007) 2: 469-475. Tautan pulih.Peloncat.com.
- Nicholson, J.W. dan Tibaldi, J.P. (1992). Formasi dan sifat semen yang disiapkan dari seng oksida dan larutan seng nitrat. J Mater Sci 27, 2420-2422 (1992). Tautan pulih.Peloncat.com.
- Timah, d.R. (Editor) (2003). Buku Pegangan Kimia dan Fisika CRC. 85th CRC Press.
- Maji, hlm. et al. (2015). Efek Zn (Tidak3)2 Pengisi pada Demillity Dielektrik dan Modulus Listrik PMMA. Bull Mater Sci 38, 417-424 (2015). Tautan pulih.Peloncat.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Seng nitrat. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- BYJU. (2020). Zinc Nitrate - Zn (NO3) 2. Pulih dari byjus.com.
- Elemen Amerika. Seng nitrat. Pulih dari Amerika.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- « Struktur seng klorida (zncl2), properti, memperoleh, penggunaan
- Kasus -kasus konkret proses etika di lembaga dan organisasi »

