Boltzmann Sejarah Konstan, Persamaan, Perhitungan, Latihan

- 3837
- 101
- Mr. Darrell Streich
Itu Konstanta Boltzmann Nilai yang menghubungkan energi kinetik rata -rata dari sistem termodinamika atau objek dengan suhu absolut dari hal yang sama. Meskipun mereka sering bingung, suhu dan energi bukanlah konsep yang sama.
Suhu adalah ukuran energi, tetapi bukan energi itu sendiri. Dengan konstanta Boltzmann, satu dihubungkan satu sama lain sebagai berikut:
DANC = (3/2) kB T
 Host Boltzmann di Wina. Sumber: Dadotet at English Wikipedia [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]
Host Boltzmann di Wina. Sumber: Dadotet at English Wikipedia [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]] Persamaan ini berlaku untuk molekul gas monoatomik yang ideal M, Di mana DANC Itu adalah energi kinetiknya yang diberikan di joules, kB Itu adalah konstanta Boltzmann dan T Ini adalah suhu absolut di Kelvin.
Dengan cara ini, ketika suhu meningkat, energi kinetik rata -rata oleh molekul zat juga meningkat, seperti yang diharapkan terjadi. Dan yang sebaliknya terjadi ketika suhu berkurang, mampu mencapai titik di mana seluruh gerakan berhenti, suhu serendah mungkin atau suhu absolut tercapai.
Saat berbicara tentang energi kinetik rata -rata, perlu diingat bahwa energi kinetik dikaitkan dengan gerakan. Dan partikel -partikel dapat bergerak dalam banyak hal, misalnya bergerak, berputar atau bergetar. Tentu saja, tidak semua akan melakukannya dengan cara yang sama, dan karena mereka yang tak terhitung jumlahnya, maka rata -rata diambil untuk mengkarakterisasi sistem.
Beberapa negara energi lebih mungkin daripada yang lain. Konsep ini sangat penting dalam termodinamika. Energi yang dipertimbangkan dalam persamaan sebelumnya adalah energi kinetik terjemahan. Tentang probabilitas negara bagian dan hubungan mereka dengan konstanta Boltzmann akan berbicara sedikit nanti.
Pada tahun 2018 Kelvin didefinisikan ulang dan bersamanya konstanta Boltzmann, yang dalam sistem internasional sekitar 1.380649 x 10-23 J. K-1. Jauh lebih presisi dapat dicapai untuk konstanta Boltzmann, yang telah ditentukan di banyak laboratorium di seluruh dunia, dengan metode yang berbeda.
[TOC]
Sejarah
Konstanta yang terkenal berutang namanya kepada fisikawan Ludwig Boltzmann (1844-1906), lahir di Wina, yang mendedikasikan hidupnya sebagai ilmuwan untuk studi perilaku statistik sistem dengan banyak partikel, dari sudut pandang mekanika Newtonian Newtonian.
Meskipun hari ini keberadaan atom diterima secara universal, pada abad kesembilan belas keyakinan tentang apakah atom itu benar -benar ada atau merupakan kecerdasan yang dengannya banyak fenomena fisik dijelaskan dalam perdebatan penuh.
Dapat melayani Anda: vektor normal: perhitungan dan contohBoltzmann adalah pembela yang kuat dari keberadaan atom, dan pada masanya dia menghadapi kritik keras terhadap pekerjaannya oleh banyak kolega, yang menganggap bahwa mereka mengandung paradoks yang tidak larut.
Dia menyatakan bahwa fenomena yang dapat diamati pada tingkat makroskopik dapat dijelaskan melalui sifat statistik partikel konstituen seperti atom dan molekul.
Kritik ini mungkin disebabkan oleh episode depresi yang mendalam yang membuatnya mengambil nyawanya sendiri pada awal September 1906, ketika dia masih memiliki banyak hal yang harus dilakukan, karena dia dianggap sebagai salah satu fisikawan teoretis besar pada waktunya dan di sana sedikit bagi bahwa ilmuwan lain akan berkontribusi untuk menguatkan kebenaran teori mereka.
Itu tidak terjadi lama setelah kematiannya ketika penemuan baru tentang sifat atom dan partikel -partikel konstituennya akan ditambahkan untuk memberikan alasan kepada Boltzmann.
Konstanta dan Planck's Boltzmann
Sekarang, konstanta Boltzmann kB Itu diperkenalkan seperti yang diketahui hari ini beberapa saat setelah karya fisikawan Austria. Itu adalah Max Planck, dalam hukumnya tentang emisi tubuh kulit hitam, sebuah karya yang disajikannya pada tahun 1901, yang pada waktu itu memberinya nilai 1,34 x 1023 J/k.
Pada tahun 1933, Boltzmann ditambahkan ke Wina sebagai poster upeti sebuah plak dengan definisi entropi yang melibatkan konstanta yang terkenal: S = kB log w, persamaan yang akan dibahas nanti.
Hari ini konstanta Boltzmann sangat diperlukan dalam penerapan undang -undang termodinamika, mekanika statistik dan teori informasi, bidang yang di mana fisikawan dengan akhir yang menyedihkan ini adalah pelopor.
Nilai dan persamaan
Gas dapat dijelaskan dalam istilah makroskopis dan juga dalam istilah mikroskopis. Untuk deskripsi pertama ada konsep -konsep seperti kepadatan, suhu dan tekanan.
Namun, harus diingat bahwa gas terdiri dari banyak partikel, yang memiliki kecenderungan global untuk perilaku tertentu. Tren itulah yang diukur secara makroskopis. Salah satu cara untuk menentukan konstanta Boltzmann adalah berkat persamaan gas ideal yang diketahui dengan baik:
P.V = n. R. T
Di Sini P Itu adalah tekanan gas, V Itu adalah volumenya, N Itu adalah jumlah tahi lalat yang ada, R Itu adalah konstanta gas dan T Itu adalah suhunya. Dalam mol gas ideal, hubungan berikut antara produk terpenuhi P.V, dan energi terjemahan kinetik K Seluruh set adalah:
Dapat melayani Anda: model materi sel -selP.V = (2/3). K
Oleh karena itu energi kinetik adalah:
K = (3/2) n.R.T
Dengan membagi dengan jumlah total molekul yang ada, yang akan disebut n, energi kinetik rata -rata dari satu partikel diperoleh:
DANC = K /n
DANC= (3/2n) n.R.T
Dalam mol ada jumlah partikel nKE, Dan oleh karena itu jumlah total partikel N = nnA, tetap:
DANC = (3/2nnKE) N.R.T
Justru hasil bagi R/nKE Ini adalah konstanta Boltzmann, ditunjukkan bahwa energi kinetik dari terjemahan rata -rata suatu partikel hanya tergantung pada suhu absolut dan bukan besaran lain seperti tekanan, volume atau bahkan jenis molekul:
DANC = (3/2) kB. T
Konstanta dan entropi Boltzmann
Gas memiliki suhu tertentu, tetapi suhu itu dapat sesuai dengan keadaan energi internal yang berbeda. Bagaimana memvisualisasikan perbedaan ini?
Pertimbangkan peluncuran 4 koin secara simultan dan cara -cara di mana mereka dapat jatuh:
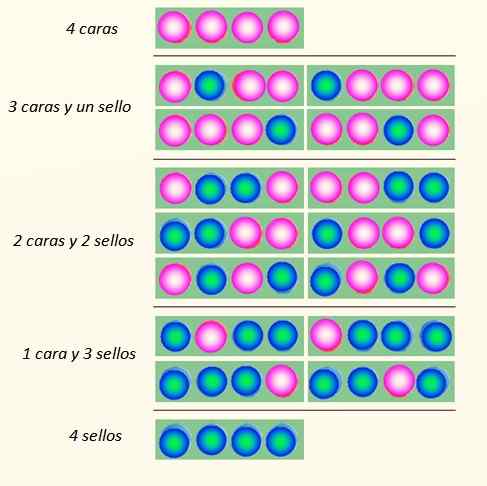 Cara di mana 4 koin bisa jatuh. Sumber: Made sendiri
Cara di mana 4 koin bisa jatuh. Sumber: Made sendiri Set koin dapat mengasumsikan total 5 negara bagian, yang dipertimbangkan Makroskopik, dijelaskan dalam gambar. Manakah dari negara -negara berikut yang akan dikatakan pembaca bahwa itu adalah yang paling mungkin?
Jawabannya harus merupakan keadaan 2 wajah dan 2 salib, karena memiliki total 6 kemungkinan, dari 16 yang diilustrasikan dalam gambar. Dan 24 = 16. Ini setara dengan negara bagian mikroskopis.
Dan bagaimana jika 20 koin diluncurkan, bukan 4? Akan ada total 2dua puluh kemungkinan atau "keadaan mikroskopis". Ini adalah angka yang jauh lebih besar dan lebih sulit untuk ditangani. Untuk memfasilitasi pengelolaan jumlah besar, logaritma sangat tepat.
Sekarang, yang tampak jelas adalah bahwa negara dengan gangguan terbesar adalah yang paling mungkin. Negara bagian yang paling banyak dipesan seperti 4 wajah atau 4 perangko sedikit lebih kecil kemungkinannya.
Entropi keadaan makroskopik S didefinisikan sebagai:
S = kB ln w
Di mana W Itu adalah jumlah negara mikroskopis yang mungkin dan kB Itu adalah konstanta Boltzmann. Sebagai ln w Itu tidak dimensi, entropi memiliki unit yang sama dengan kB: Joule/k.
Ini adalah persamaan terkenal di batu nisan Boltzmann di Wina. Namun, lebih dari entropi, yang relevan adalah perubahannya:
Itu dapat melayani Anda: variabel termodinamika: yang mana dan latihan diselesaikanΔS = kB ln w2 - kB ln w1 = kB ln (w2/w1)
Bagaimana k dihitungB?
Nilai konstanta Boltzmann diperoleh secara eksperimental dengan pengukuran berdasarkan Termometri akustik, yang dilakukan dengan menggunakan properti yang menetapkan ketergantungan pada kecepatan suara dalam gas dengan suhu yang sama.
Memang, kecepatan suara dalam gas diberikan oleh:

Badiabatik = γp
Dan ρ adalah kepadatan gas. Untuk persamaan sebelumnya, P Itu adalah tekanan gas yang dimaksud dan γ Ini adalah koefisien adiabatik, yang nilainya untuk gas tertentu ditemukan di tabel.
Lembaga metrologi juga mengalami cara lain untuk mengukur konstan, seperti Termometri kebisingan Johnson, yang menggunakan fluktuasi termal yang terjadi secara acak dalam bahan, khususnya pada pengemudi.
Latihan terpecahkan
-Latihan 1
Menemukan:
a) energi kinetik dari terjemahan rata -rata DANC yang memiliki molekul gas ideal pada 25 ºC
b) energi kinetik terjemahan K dari molekul dalam 1 mol gas ini
c) kecepatan rata -rata molekul oksigen pada 25 ºC
Fakta
Moksigen = 16 x 10 -3 kg/mol
Larutan
ke) DANC = (3/2) k t = 1.5 x 1.380649 x 10-23J. K-1 x 298 k = 6.2 x 10-dua puluh satu J
B) K = (3/2) n.R.T = 5 x 1 mol x 8.314 j/mol .K x 298 k = 3716 j
C) DANC = ½ mV2, Dengan mempertimbangkan bahwa molekul oksigen adalah diatomik dan massa molar harus dikalikan dengan 2, itu akan menjadi:
 -Latihan 2
-Latihan 2
Temukan perubahan entropi saat 1 mol gas ditempati dengan volume 0.5m3 Itu mengembang untuk menempati 1 m3.
Larutan
ΔS = kB ln (w2/w1)
W2= 2NW1 (Ada 24 Status mikroskopis untuk peluncuran 4 koin, ingat?)
Di mana n adalah jumlah partikel yang ada di 0.5 mol gas 0.5 x nKE:
ΔS = kB ln (2N W1/w1) = kB Ln 2N= kB 0.5nKE Ln 2 = 2.88 j/k
Referensi
- Atkins, hlm. 1999. Kimia Fisik. Edisi Omega. 13-47.
- Bauer, w. 2011. Fisika untuk Teknik dan Ilmu Pengetahuan. Volume 1. MC Graw Hill. 664-672.
- Giancoli, d. 2006. Fisika: Prinsip dengan aplikasi. 6 ... Ed Prentice Hall. 443 -444.
- Sears, Zemansky. 2016. Fisika Universitas dengan Fisika Modern. 14. Ed. Volume 1. 647-673.
- Jika redefinisi. Kelvin: Boltzmann Constant. Pulih dari: nist.Pemerintah
- « Bagaimana cara meminta maaf kepada orang yang dicintai dalam 9 langkah
- Apa itu persahabatan dan bagaimana menumbuhkannya 10 kunci »

