Mekanisme korosi galvanik, contoh, perlindungan

- 2442
- 319
- Tommie Smith
Itu Korosi galvanik atau elektrokimia Ini adalah proses di mana logam atau paduan terdegradasi lebih vertikal dibandingkan dengan oksidasi konvensionalnya. Dapat dikatakan bahwa itu adalah oksidasi yang dipercepat, dan bahkan dengan sengaja dipimpin; Seperti dalam baterai atau baterai.
Ini terjadi di bawah serangkaian kondisi. Pertama, harus ada logam aktif, disebut anoda. Juga, dan kedua, harus ada sedikit logam mulia reaktif yang disebut katoda. Kondisi ketiga dan keempat adalah adanya media di mana elektron disebarkan, seperti air, dan spesies ionik atau elektrolit.
 Mahkota besi teroksidasi. Sumber: Pixnio.
Mahkota besi teroksidasi. Sumber: Pixnio. Korosi galvanik dapat diamati terutama di lingkungan laut atau di tepi pantai. Arus udara mengangkat massa uap air, yang pada gilirannya, menyeret beberapa ion; Yang terakhir akhirnya menempel pada lapisan tipis air atau tetesan yang bertumpu pada permukaan logam.
Kondisi kelembaban dan salinitas ini mendukung korosi logam. Artinya, mahkota besi seperti yang ada di gambar superior akan teroksidasi lebih cepat jika terpapar ke dekat laut.
Kemudahan yang harus dioksidasi logam dibandingkan dengan yang lain dapat diukur secara kuantitatif melalui potensi reduksi; Dalam buku kimia ada banyak meja dengan potensi ini dan. Semakin negatif, semakin besar kecenderungan Anda untuk mengoksidasi.
Juga, jika logam ini berada di hadapan orang lain dengan potensi reduksi yang sangat positif, oleh karena itu memiliki ΔE besar, oksidasi logam reaktif akan lebih agresif. Faktor -faktor lain, seperti pH, gaya ionik, kelembaban, adanya oksigen, dan hubungan antara area logam yang teroksidasi dan yang dikurangi, juga penting.
[TOC]
Mekanisme
Konsep dan reaksi
Sebelum mengatasi mekanisme di balik korosi galvanik, konsep -konsep tertentu harus diklarifikasi.
Dalam reaksi Rédox, spesies kehilangan elektron (teroksidasi) sementara yang lain memenangkannya (dikurangi). Elektroda tempat oksidasi terjadi disebut anoda; Dan di mana pengurangan terjadi, katoda (dalam bahasa Inggris aturan nemonik biasanya digunakan Redcat untuk mengingat).
Jadi, untuk elektroda (satu bagian, sekrup, dll.) dari logam M, jika ini dioksidasi dikatakan bahwa itu adalah anoda:
M => mN+ + ne-
Jumlah elektron yang dilepaskan akan sama dengan besarnya beban positif kation mN+ hasilnya.
Kemudian, elektroda atau logam lain (kedua logam harus bersentuhan dalam beberapa cara), menerima elektron yang dilepaskan; Tetapi ini tidak menderita reaksi kimia jika mereka mendapatkan elektron, karena hanya akan menghidupkannya (arus listrik).
Oleh karena itu, harus ada spesies lain dalam solusi yang dapat diterima oleh elektron ini; Mudah mengurangi ion logam, misalnya:
Dapat melayani Anda: sistem tidak homogenRN+ + ne- => R
Artinya, lapisan logam R akan terbentuk dan elektroda akan menjadi lebih berat; sementara logam m akan kehilangan massa karena atom mereka larut.
Depolarisasi
Dan jika tidak ada kation logam yang dapat dikurangi secara memadai? Dalam hal ini, spesies lain yang ada di tengah akan mengambil elektron: depolarizadores. Ini terkait erat dengan ph: o2, H+, Oh- dan H2SALAH SATU.
Elektron gain oksigen dan air dalam reaksi yang diekspresikan oleh persamaan kimia berikut:
SALAH SATU2 + 2h2O + 4e- => 4OH-
Sementara ion h+ Mereka berubah menjadi h2:
2h+ + 2e- => H2
Yaitu, oh spesies- dan H2 Mereka adalah produk umum dari korosi galvanik atau elektrokimia.
Bahkan jika logam R tidak berpartisipasi dalam reaksi apa pun, fakta menjadi lebih mulia bahwa M mempromosikan oksidasi; Dan akibatnya, akan ada produksi ion OH yang lebih besar- o gas hidrogen. Karena, bagaimanapun juga, itu adalah perbedaan antara potensi reduksi, ΔE, salah satu mesin utama dari proses ini.
Korosi besi
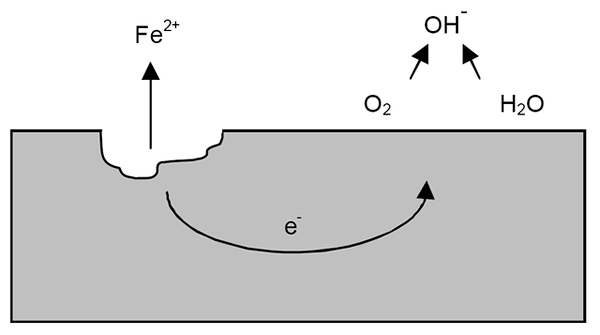 Mekanisme korosi untuk zat besi. Sumber: Wikipedia.
Mekanisme korosi untuk zat besi. Sumber: Wikipedia. Setelah klarifikasi sebelumnya, contoh korosi besi (gambar superior) dapat diatasi. Misalkan ada lapisan air tipis di mana oksigen larut. Tanpa adanya logam lain, itu akan menjadi depolarizadores yang akan menandai pedoman reaksi.
Dengan demikian, zat besi akan kehilangan beberapa atom di permukaannya untuk larut dalam air sebagai kation iman2+:
Fe => iman2+ + 2e-
Kedua elektron akan menempuh potongan besi untuk menjadi konduktor listrik yang baik. Sehingga diketahui di mana oksidasi atau situs anodik dimulai; Tetapi tidak di mana pengurangan atau lokasi situs katodik akan berlanjut. Situs katodik bisa berada di mana saja; Dan semakin tinggi area yang mungkin, lebih buruk akan menjadi korosi logam.
Misalkan elektron mencapai titik seperti yang ditunjukkan pada gambar atas. Ada oksigen dan air menderita reaksi yang sudah dijelaskan, yang dilepaskan oleh OH-. Anion ini oh- Mereka dapat bereaksi dengan iman2+ Untuk membentuk iman (oh)2, yang memicu dan menderita oksidasi berikutnya yang akhirnya mengubahnya menjadi karat.
Sementara itu, situs anodik semakin retak.
Contoh
Dalam kehidupan sehari -hari, contoh korosi galvanik banyak. Kami tidak perlu merujuk pada mahkota besi: artefak apa pun yang terbuat dari logam dapat menderita proses yang sama di hadapan lingkungan yang basah dan salin.
Dapat melayani Anda: kelompok fosfatSelain pantai, musim dingin juga dapat menyumbangkan kondisi ideal untuk korosi; Misalnya, saat Anda melempar garam ke salju di jalan untuk mencegah mobil berseluncur.
Dari sudut pandang fisik, dalam serikat pekerja yang dilas dari dua logam dapat mempertahankan kelembaban, menjadi situs korosi aktif. Ini karena kedua logam berperilaku seperti dua elektroda, dan yang paling reaktif akan kehilangan elektron mereka.
Jika OH Ion Production- Ini cukup besar, Anda bahkan dapat menjalankan cat mobil atau artefak yang dimaksud.
Indeks anodik
Seseorang dapat membangun contoh korosi galvanik mereka sendiri menggunakan tabel potensial reduksi. Namun, tabel indeks anodik (disederhanakan dengan sendirinya) akan dipilih untuk menggambarkan poin ini.
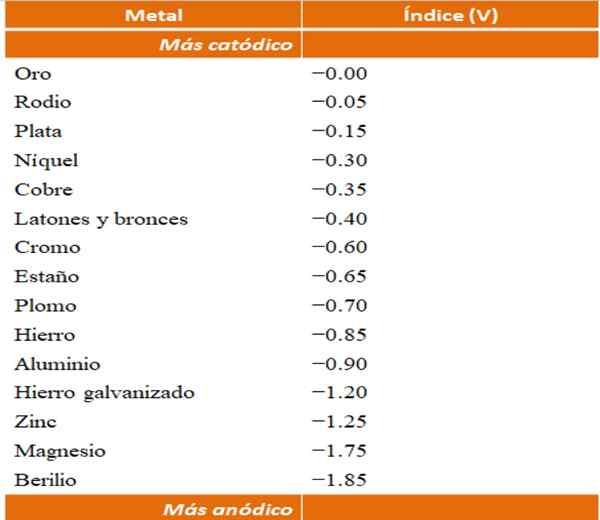 Indeks anodik untuk berbagai logam atau paduan. Sumber: Wikipedia.
Indeks anodik untuk berbagai logam atau paduan. Sumber: Wikipedia. Misalkan kita ingin membangun sel elektrokimia. Logam yang merupakan bagian atas dari tabel indeks anodik lebih banyak katoda; yaitu, mereka mudah dikurangi dan karena itu akan sulit untuk memilikinya dalam solusi. Sedangkan logam yang berada di bagian bawah lebih anodik atau reagen, dan mudah dijalankan.
Jika kita memilih emas dan berilium, kedua logam tidak bisa bersama untuk waktu yang lama, karena berilium akan teroksidasi dengan ekstrem cepat.
Dan jika sebaliknya kita memiliki solusi ag ion+ Dan kami membenamkan batang aluminium di dalamnya, ia akan larut pada saat yang sama yang memicu partikel perak logam. Jika bilah ini terhubung ke elektroda grafit, elektron akan melakukan perjalanan ke sana untuk menyetor perak seperti elektrokimia seperti film perak.
Dan jika alih -alih bilah aluminium keluar dari tembaga, solusinya akan menjadi kebiruan dengan adanya ion Cu2+ di dalam air.
Perlindungan terhadap korosi elektrokimia
Pelapis pengorbanan
Misalkan itu dimaksudkan untuk melindungi lamina korosi di hadapan logam lain. Pilihan termudah adalah menambahkan magnesium, yang akan menutupi seng sehingga, setelah teroksidasi, elektron yang dilepaskan dari magnesium mengurangi kation zn2+ kembali.
Namun, film MGO tentang seng lebih cepat daripada nanti akan berakhir retak, menyediakan situs saat ini dengan kepadatan tinggi; yaitu, korosi seng akan meningkat tajam tepat di titik -titik itu.
Teknik perlindungan terhadap korosi elektrokimia ini dikenal sebagai penggunaan kelongsong pengorbanan. Yang paling terkenal adalah seng, digunakan dalam teknik terkenal yang disebut galvanisasi. Di dalamnya, logam m tertutup, terutama besi, seng (iman/zn).
Dapat melayani Anda: Phenolphthalein (C20H14O4)Sekali lagi, seng teroksidasi dan oksida berfungsi untuk menutupi zat besi dan mengirimkan elektron yang mengurangi keyakinan2+ yang bisa dibentuk.
Pelapis mulia
Misalkan Anda ingin melindungi lembaran seng yang sama, tetapi sekarang kromium akan digunakan sebagai pengganti magnesium. Chromium lebih mulia (lebih banyak katodik, lihat tabel indeks anodik) daripada seng, dan itulah sebabnya ia berfungsi sebagai lapisan yang mulia.
Masalah jenis lapisan ini adalah bahwa sekali retak, itu akan mempromosikan dan lebih lanjut mempercepat oksidasi logam di bawah ini; Dalam hal ini, seng dikorosi bahkan lebih dari sekadar ditutupi dengan magnesium.
Dan akhirnya, ada lapisan lain yang terdiri dari lukisan, plastik, antioksidan, lemak, resin, dll.
Eksperimen Anak
Pelat besi dalam garam tembaga
Eksperimen sederhana dapat dirancang dari tabel indeks anodik yang sama. Melarutkan jumlah yang wajar (kurang dari 10 gram) CUSO4· 5h2Atau di dalam air, seorang anak diminta untuk merendam di pelat besi yang dipoles. Foto diambil dan prosesnya diizinkan untuk berkembang selama beberapa minggu.
Pembubaran awalnya kebiruan, tetapi akan mulai kehilangan pewarnaan sementara pelat besi memperoleh warna tembaga. Ini karena tembaga mulia dari besi, dan karena itu kationnya cu2+ Mereka akan direduksi menjadi tembaga logam dari ion yang ditugaskan oleh oksidasi besi:
Fe => iman2+ + 2e-
Cu2+ + 2e- => Cu
Pembersihan oksida perak
Objek perak menghitam dari waktu ke waktu, terutama jika mereka bersentuhan dengan sumber senyawa belerang. Oksidanya dapat dihilangkan jika objek direndam dalam bak air dengan natrium bikarbonat dan foil aluminium. Bikarbonat menyediakan elektrolit yang akan memfasilitasi pengangkutan elektron antara objek dan aluminium.
Akibatnya, anak dapat menghargai bahwa objek kehilangan bintik -bintik hitamnya dan akan bersinar dengan warna peraknya yang khas; Sedangkan aluminium foil akan berjalan sampai menghilang.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2019). Korosi galvanik. Diperoleh dari: di.Wikipedia.org
- Stephen Lower. (16 Juni 2019). Korosi electochemical. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Universitas Terbuka. (2018). 2.4 Proses Korosi: Korosi Galvanik. Pulih dari: terbuka.Edu
- Layanan Teknis Pelanggan Sikat Wellman Inc. (S.F.). Panduan Korosi Galvanik. Sikat bahan rekayasa wellman.
- Giorgio Carboni. (1998). Eksperimen dalam Electochemistry. Diperoleh dari: Fensci.com

