Konsep elektrolit yang kuat, karakteristik, contoh

- 706
- 17
- Jessie Harvey
A Elektrolit yang kuat Itu semua zat yang dilarutkan dalam air, atau dalam pelarut tertentu, sepenuhnya dipisahkan pada ion. Oleh karena itu, tidak boleh ada solusi sebagai molekul netral, atau sebagai padatan yang tidak larut. Elektrolit yang kuat dapat berupa garam, asam atau basa, asalkan mereka memisahkan atau sepenuhnya ionik.
Contoh paling representatif dari elektrolit adalah garam umum, natrium klorida, NaCl. Dalam larutan berair, kristal NaCl terdisosiasi secara keseluruhan untuk menghasilkan ion Na+ dan Cl-, Itu berakhir di sekitar molekul air. Kemudian dikatakan bahwa garam berperilaku seperti elektrolit yang kuat ketika kelarutannya sangat tinggi air.
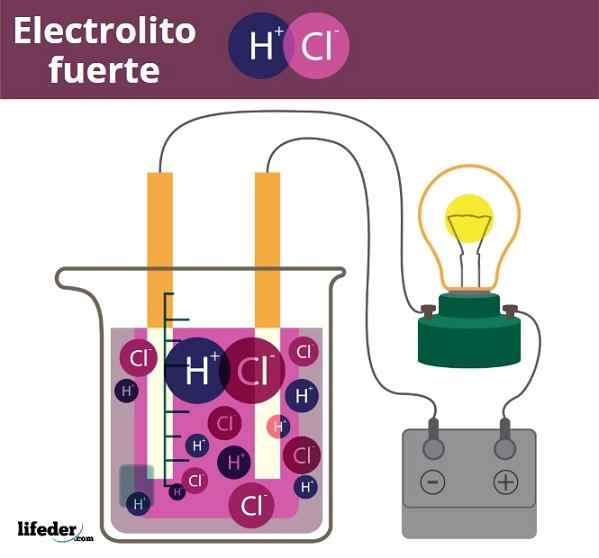 Contoh Fuero Electrolite. HCl, asam klorida, lepaskan ion H3O+ dan CL-
Contoh Fuero Electrolite. HCl, asam klorida, lepaskan ion H3O+ dan CL- Agak mirip adalah kasus asam dan basa. Ketika ini kuat, solusi mereka dalam air menghasilkan jumlah maksimum ion H3SALAH SATU+ Atau oh-, Jadi perubahan pH tiba -tiba. Contoh asam dan basa kuat adalah asam nitrat, hno3, dan kalium hidroksida, KOH, masing -masing.
Penting untuk mengetahui bagaimana mengidentifikasi elektrolit yang kuat saat menyiapkan solusi yang sangat ionik, atau asam yang sangat kuat atau cara basa.
[TOC]
Karakteristik elektrolit yang kuat
Kelarutan
Elektrolit yang kuat ditandai dengan menjadi zat air yang sangat larut. Apakah padatan atau gas, saat bersentuhan dengan air, itu tidak boleh terlalu tertunda untuk larut sepenuhnya. Jika garam, misalnya, sedikit larut dalam air, dapat dibuang sebagai elektrolit yang kuat.
Konduktivitas ionik
Elektrolit yang kuat tidak hanya sangat larut dalam air, tetapi juga menghasilkan sejumlah besar ion. Berkat muatan listrik dari ion -ion ini, elektron dapat dengan nyaman melakukan perjalanan solusi. Ini tercermin dalam peningkatan konduktivitas ionik sehubungan dengan air murni. Itulah sebabnya solusi ionik memimpin listrik yang sangat baik.
Dapat melayani Anda: klorin: sejarah, sifat, struktur, risiko, penggunaanNetralitas saline
Banyak elektrolit kuat saline, saat larut dalam air, tidak menghasilkan perubahan pH apa pun. Ini berarti bahwa larutan garam ini tidak asam atau basa, tetapi netral, dengan pH mendekati 7.
Namun, mungkin ada asam atau garam basa yang mudah dilarutkan dalam air, dan yang juga menghasilkan ion lengkap. Misalnya, natrium karbonat2BERSAMA3, larut untuk menghasilkan ion na+ dan co32-, Tetapi pH solusinya adalah dasar.
Contoh elektrolit yang kuat
 Sodium klorida adalah contoh paling representatif dari elektrolit yang kuat. Sumber: Cristian V. /Cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0)
Sodium klorida adalah contoh paling representatif dari elektrolit yang kuat. Sumber: Cristian V. /Cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0) Elektrolit yang kuat, menjadi begitu banyak, dibagi menjadi tiga klasifikasi: asam kuat, basa kuat, dan produk garam larut dari netralisasi antara dua yang pertama.
Asam kuat
Asam kuat saat larut dalam air, tanpa masalah, harus menghasilkan jumlah h maksimum yang mungkin3SALAH SATU+, Jadi asam harus sepenuhnya ion; Artinya, itu tidak boleh ada sebagai molekul netral dengan proton asam tanpa melepaskan.
Contoh asam ini adalah:
-HCl, asam klorida, melepaskan ion H3SALAH SATU+ dan Cl-
-HF, asam fluorhorat, melepaskan ion H3SALAH SATU+ dan f-
-Hno3, Asam nitrat, lepaskan hones h3SALAH SATU+ dan tidak3-
-Hclo4, asam perklorat, melepaskan ion H3SALAH SATU+ dan clo4-
-Hio4, asam periódic, melepaskan ion H3SALAH SATU+ dan io4-
-H2Sw4, Asam Sulfat, Lepaskan Hones H3SALAH SATU+ Dan sebagainya42-
Alasan mengapa ion hidrium, h3SALAH SATU+, Itu selalu ada (dengan satu atau lain cara), itu karena hidrogen yang mereka donasi diterima oleh molekul air:
HCL + H2O → h3SALAH SATU+ + Cl-
Reaksinya langsung dan tidak dapat diubah. Ini adalah karakteristik asam yang kuat, yang pada gilirannya adalah elektrolit yang kuat karena ionisasi penuh dalam air.
Dapat melayani Anda: hidrokarbon alifatik: sifat, nomenklatur, reaksi, jenisPangkalan yang kuat
Basis yang kuat, larut dalam air tanpa masalah, harus melepaskan ion OH- dari kristal yang sama, atau molekul air yang tidak dapat diatasi.
Banyak basis yang kuat terdiri dari ion dan padatan non -molekul. Beberapa contoh pangkalan ini yang berperilaku sebagai elektrolit yang kuat adalah:
-Lioh, lithium hidroksida, melepaskan ion OH- dan li+
-NaOH, natrium hidroksida, melepaskan ion OH- dan na+
-Rboh, rubidio hidroksida, melepaskan ion OH- dan RB+
-CA (OH)2, kalsium hidroksida, lepaskan ion OH- dan ca2+
-Sr (oh)2, Strontium hidroksida, lepaskan ion OH- dan MR2+
-Ba (oh)2, Barium hidroksida, lepaskan ion OH- dan ba2+
-Nah, natrium hidrida, melepaskan ion OH- dan gas hidrogen, h2
-Nanh2, natrium amiduro, lepaskan ion oh- dan Gas Amonia, NH3
Kamu keluar
Hallobasi Elektrolit yang kuat saat larut dalam air harus benar -benar ion. Banyak dari mereka tidak menghasilkan perubahan pH. Ini karena ion mereka sangat stabil, sehingga mereka tidak berpartisipasi dalam keseimbangan hidrolisis untuk mengubah sifat air. Contoh garam ini adalah:
-NaCl, natrium klorida, melepaskan ion Na+ dan Cl-
-Agno3, Nitrat perak, lepaskan ion ag+ dan tidak3-
-Kakak3, Sodium nitrat, lepaskan ion Na+ dan tidak3-
-K2Sw4, Kalium sulfat, melepaskan ion k+ Dan sebagainya42-
-Mgcl2, Magnesium klorida, melepaskan ion Mg2+ dan Cl-
-Cuso4, Cupric sulfate, melepaskan ion Cu2+ Dan sebagainya42-
-KBR, Kalium bromida, melepaskan ion K+ dan br-
-NH4CL, amonium klorida, melepaskan ion NH4+, Cl-, H3SALAH SATU+ dan gas amonia
Itu dapat melayani Anda: merkuri klorida (ii): struktur, sifat, mendapatkan, menggunakan-NACN, natrium sianida, melepaskan ion Na+ dan cn-
-Na3PO4, Sodium fosfat, melepaskan ion Na+ dan po43-
-Crcl3, Chromic Chloride, melepaskan ion CR3+ dan Cl-
-Aub3, Auric bromide, melepaskan au ion3+ dan br-
-Snso4, Estany sulfat, melepaskan ion sn2+ Dan sebagainya42-
NH4CL adalah contoh kontradiktif: itu sepenuhnya terionisasi, tetapi pada saat yang sama menghasilkan molekul netral amonia karena itu adalah garam asam.
Perbedaan antara elektrolit yang kuat dan lemah
Meskipun perbedaan antara elektrolit yang kuat dari yang lemah telah ditetapkan secara tidak langsung, ini akan disajikan di bawah ini sebagai kesimpulan:
-Elektrolit yang kuat sangat larut di perairan; Elektrolit lemah tidak.
-Ionisasi elektrolit yang lemah adalah parsial, yang berarti bahwa mungkin ada molekul netral dalam larutan. Sebaliknya, elektrolit yang kuat ada secara eksklusif sebagai ion.
-Asam dan basa lemah, yang pada gilirannya adalah elektrolit yang lemah, tidak memisahkan diri sepenuhnya dalam air, sehingga mereka menghasilkan lebih sedikit ion h3SALAH SATU+ Atau oh- Apa yang bisa diharapkan.
-Halth -halin Elektrolit yang kuat hampir tidak terhidrolisis dibandingkan dengan elektrolit yang lemah. Oleh karena itu, solusi yang pertama cenderung netral, kecuali ketika mereka berurusan dengan asam atau garam basa.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Elektrolit yang kuat. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Definisi dan contoh elektrolit yang kuat. Pulih dari: thinkco.com
- Chung & Chieh. (5 Juni 2019). Elektrolit. Libretteks Kimia. Pulih dari: chem.Librettexts.org

