Konsep elektrolit yang lemah, karakteristik, contoh
- 4411
- 69
- Joseph Nader PhD
A Elektrolit lemah Itu semua zat yang larut dalam air tidak sepenuhnya terionisasi. Ini berarti bahwa pembubarannya menghasilkan atau melepaskan jumlah ion yang lebih rendah dari yang bisa diharapkan. Proses ionisasi ini ditetapkan oleh keseimbangan hidrolisis, di mana ion seperti H terbentuk3SALAH SATU+ Atau oh-.
Elektrolit yang lemah biasanya merupakan senyawa kovalen, yang molekulnya cenderung tetap netral tanpa mendapatkan beban ionik. Banyak dari elektrolit ini terdiri dari molekul organik dengan gugus fungsi yang terionisasi, meskipun ada juga tipe anorganik, termasuk beberapa oksacid.

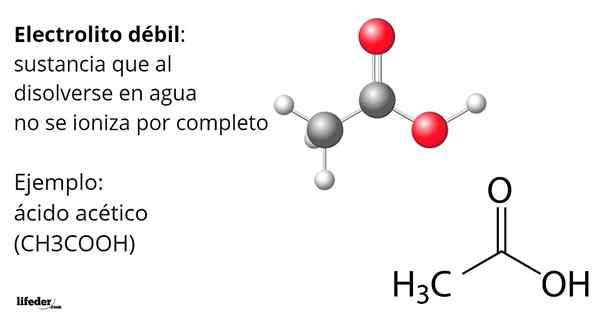
Asam Asetat, Cho3CoOH, adalah contoh elektrolit yang lemah. Molekulnya memiliki kelompok fungsional yang menjadi ciri keasamannya dalam air. Namun, ketika tidak semua molekulnya dilarutkan menghasilkan ion H3SALAH SATU+ mengubah anion asetat, cho3Mendekut-, Tapi mereka tetap netral, terprotonasi.
Beberapa elektrolit lebih lemah dari yang lain, yang akan tergantung pada tingkat ionisasi mereka. Ketika mereka larut mereka menyebabkan perubahan moderat dalam pH. Dengan demikian, kami memiliki elektrolit asam atau asam basa.
[TOC]
Karakteristik electolites yang lemah
Mereka adalah senyawa kovalen
Secara umum, elektrolit lemah adalah senyawa kovalen, sehingga unit konstituennya adalah molekul.
Mereka menderita hidrolisis
Molekul -molekul ini memiliki kemampuan untuk memperoleh beban ionik. Untuk melakukan ini, berpartisipasi dalam keseimbangan hidrolisis, di mana molekul air adalah "bagian" dalam oh-, atau terima hidrogen untuk berubah menjadi h3SALAH SATU+.
Semakin sedikit kemungkinan atau tidak stabil adalah hidrolisis, semakin rendah jumlah atau konsentrasi ion yang ada dalam pembubaran elektrolit ini.
Mereka memiliki konduktivitas rendah
Larutan elektrolit yang lemah bukanlah konduktor listrik yang baik, dibandingkan dengan elektrolit yang kuat. Ini justru karena jumlah ion terendah dalam larutan, yang membuatnya sulit untuk melewati elektron melalui air.
Itu dapat melayani Anda: asam manganik atau permanganatContoh elektrolit yang lemah
 Asam asetat cuka apel adalah contoh paling representatif dari elektrolit yang lemah. Sumber: Pxhere.
Asam asetat cuka apel adalah contoh paling representatif dari elektrolit yang lemah. Sumber: Pxhere. Asam karbonat
Molekul asam karbonat, h2BERSAMA3, Saat larut dalam air, reaksi hidrolisis berikut menderita:
H2BERSAMA3 + H2Atau ⇌ hco3- + H3SALAH SATU+
Masalahnya adalah tidak semua h2BERSAMA3 Itu terionisasi dalam HCO3-. Selain itu, h2BERSAMA3 Itu tidak proporsional dalam karbon dioksida dan air, yang selanjutnya mengurangi konduktivitas larutan ini.
Untuk contoh yang tersisa, fakta ini akan residi: molekul, yang pada prinsipnya netral, memperoleh beban ionik, dan dalam proses yang dimediasi oleh hidrolisis ada ion h3SALAH SATU+ Atau oh-.
AmonyoAc
Molekul amonia, NH3, Saat larut dalam air, reaksi hidrolisis berikut menderita:
NH3 + H2Atau ⇌ nh4+ + Oh-
Solusi amonia ini menembakkan aroma yang tajam.
Kali ini kami memiliki ion OH-. Amonia adalah basa lemah, sedangkan asam karbonat, asam lemah. Oleh karena itu, asam dan basa lemah diklasifikasikan sebagai elektrolit yang lemah, karena mereka sebagian terionisasi tanpa melepaskan konsentrasi tinggi hones H3SALAH SATU+ Atau oh-, masing -masing.
KEAsam Fosfsalah satukaya
Asam fosfat, h3PO4, Ini adalah contoh oxoacid lemah, yang pada gilirannya adalah elektrolit:
H3PO4+ H2Atau ⇌ h2PO4- + H3SALAH SATU+
Asam fosfat masih mampu menderita dua disosiasi lainnya, satu untuk masing -masing hidrogen asam (total tiga). Konsentrasi h3SALAH SATU+ Diproduksi lebih kecil jika dibandingkan dengan oxoacid yang kuat, seperti asam nitrat, hno3, yang merupakan elektrolit yang kuat. Semakin lemah elektrolit, semakin sedikit asam atau basa.
Hydsalah satuGeno
Hidrogen fluorida, HF, adalah contoh senyawa kovalen anorganik yang, tanpa menjadi oksoasid, adalah elektrolit yang lemah karena merupakan asam lemah. Saat melarutkan dalam air, asam fluorhoric diproduksi, yang sebagian terionisasi:
Dapat melayani Anda: kobalt hidroksidaHF+ H2Atau ⇌ f- + H3SALAH SATU+
Meskipun tidak menjadi elektrolit yang kuat, asam fluorida mampu "memakan" gelas bahan yang biasanya digunakan untuk menyimpan larutan asam.
Piridin
Piridin, c5H5N, adalah amina yang dihidrolisis untuk membentuk ion oh-:
C5H5N + h2Atau ⇌ c5H5NH + + Oh-
Piridin lebih mendasar daripada amonia, sehingga ionisasinya akan lebih besar dan oleh karena itu, akan menghasilkan konsentrasi ion OH yang lebih besar-.
KEAsam CianhyoDrico
Asam cyanhydric, HCN, juga merupakan contoh lain dari asam dan elektrolit yang lemah:
HCN + H2Atau ⇌ cn- + H3SALAH SATU+
Garam yang tidak larut
Poin ini kontroversial. Sejauh ini elektrolit lemah telah diklasifikasikan sebagai asam atau basa lemah, ditandai dengan ionisasi parsial mereka. Namun, garam yang tidak larut dalam air, yang sudah terionisasi dalam kristal mereka, juga dianggap sebagai elektrolit yang lemah.
Saat larut dengan kesulitan dalam air, jumlah ion yang dilepaskan dalam larutan kecil jika dibandingkan dengan garam yang larut. Dalam pengertian ini, garam yang tidak larut menghasilkan solusi yang kurang konduktif, yang melampaui mereka sedikit sebagai elektrolit yang kuat.
Untuk alasan ini, di sini akan diasumsikan bahwa garam -garam ini termasuk dalam kelompok elektrolit yang lemah, bahkan ketika larut menghasilkan ion netral dan molekul netral dengan derajat ionisasi.
Perak klorida
Perak klorida, agcl, larut dalam air untuk menghasilkan ion Ag+ dan Cl-. Namun, itu adalah garam yang cukup tidak larut. Jumlah ion yang dilepaskan jauh lebih rendah dari apa yang akan terjadi jika benar -benar larut, seperti halnya nitrat perak, agno3, Elektrolit yang kuat.
Dapat melayani Anda: fase tersebarKalsium karbonat
Kalsium karbonat, caco3, Itu adalah garam yang tidak larut yang dengan melarutkan sebagian menghasilkan ion Ca2+ dan co32-. Garam ini, tidak seperti agcl, adalah dasar, karena co32- dihidrolisis untuk menghasilkan ion oh-.
Seng sulfat
Seng sulfat, zonso4, Sebagian larut dalam air untuk menghasilkan ion Zn2+ Dan sebagainya42-.
Kalsium fluoride
Kalsium fluoride, kaf2, Secara alami ditemukan sebagai mineral fluorit, larut hanya di dalam air untuk menghasilkan ion Ca2+ dan f-.
Magnesium oksida
Magnesium oksida, mgo, adalah senyawa ionik yang agak tidak larut dalam air. Bagian kecil yang larut bereaksi untuk berubah menjadi hidroksida yang sesuai, Mg (OH)2, yang merupakan yang sebenarnya bertanggung jawab atas penampilan ion MG2+ dan oh-.
Oleh karena itu, MGO, meskipun ionik, tidak dapat diklasifikasikan sebagai elektrolit yang kuat, karena di dalam air tidak melepaskan ion kristal sendiri (mg2+ SAYA2-).
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Chung & Chieh. (5 Juni 2019). Elektrolit. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Helmestine, Todd. (11 Februari 2020). Definisi dan contoh elektrolit yang lemah. Pulih dari: thinkco.com
- Danielle Reid. (2020). Elektrolit Lemah: Definisi & Contoh. Belajar. Pulih dari: belajar.com
- « Latar belakang girondinos, siapa Anda dan pemimpin
- Karakteristik segitiga miring, contoh, latihan »

