Elektron internal
- 3801
- 414
- Tommie Smith
Kami menjelaskan apa itu elektron internal, karakteristiknya dan memberikan beberapa contoh
Apa itu elektron internal?
Setiap kali kita memikirkan sebuah atom, kita membayangkan inti yang dibentuk oleh proton dan neutron, dikelilingi oleh elektron yang berputar di sekitarnya, mirip dengan bagaimana planet -planet berputar di sekitar matahari.
Tetapi tidak semua elektron sama dan dua kelas dapat dibedakan, tergantung pada seberapa dekat atau jauh mereka dari nukleus atom.
Beberapa lebih jauh dari nukleus dan disebut elektron valencia. Ini bertanggung jawab atas semua reaksi kimia yang kita tahu. Di samping itu, Mereka yang paling dekat dengan nukleus dan lebih kuat bersatu dengan itu, adalah yang kita sebut elektron internal.
Karakteristik elektron internal
Mereka adalah elektron yang paling stabil
Sebagai aturan umum, semakin rendah tingkat energi elektron, ini lebih stabil. Elektron internal menempati orbital pada tingkat energi terendah dari sebuah atom, oleh karena itu, mereka juga merupakan elektron yang paling stabil.
Mereka lebih kuat bersatu dengan nukleus
Nukleus menarik elektron karena keduanya memiliki beban yang berlawanan: nukleus positif saat elektron negatif. Kekuatan ini meningkat seiring jaraknya jarak.
Sebagai konsekuensi dari ini, elektron internal, yang merupakan yang paling dekat dengan nukleus, juga yang paling kuat terkait dengan yang sama. Untuk alasan yang sama ini, mereka juga merupakan elektron yang paling sulit untuk dihapus.
Mereka bukan bagian dari ikatan kimia
Ketika satu atom mendekati yang lain, hal pertama yang harus disentuh adalah elektron terluar mereka. Untuk alasan ini, hanya elektron Valencia yang mengintervensi reaksi kimia. Elektron internal atau berpartisipasi dalam ikatan kimia, juga tidak terlibat dalam reaksi kimia apa pun.
Itu dapat melayani Anda: berapa banyak elektron custain yang dimiliki karbon?Mereka sangat perisai
Ini berarti bahwa elektron internal berdiri di antara elektron eksternal dan nukleus, menciptakan semacam layar yang mengurangi gaya nukleus menarik elektron valensi.
Mereka selalu datang berpasangan
Di setiap orbital hanya ada dua elektron dengan putaran berlawanan, yang disebut elektron berpasangan (yang merupakan cara lain untuk mengatakan bahwa mereka membentuk pasangan). Seperti orbital di mana elektron internal berada, mereka selalu sepenuhnya penuh, jadi elektron ini selalu dipasangkan.
Bagaimana kita tahu berapa banyak elektron internal yang dimiliki sebuah atom?
Mengetahui berapa banyak elektron internal yang memiliki atom sangat sederhana. Anda hanya perlu tahu berapa banyak elektron yang dimiliki atom, dan berapa banyak elektron itu milik lapisan Valencia. Semua elektron lainnya adalah elektron internal.
Tapi bagaimana kita mengetahui angka -angka ini? Di bagian berikut kami menjelaskannya.
Jumlah total elektron sama dengan jumlah atom
Karena atom netral (yaitu, mereka tidak memiliki muatan listrik bersih), mereka harus memiliki jumlah beban positif (proton) yang sama dengan beban negatif (elektron). Karena bilangan atom menunjukkan berapa banyak proton dalam nukleus, jadi itu juga menunjukkan berapa banyak elektron atom yang ada ketika itu netral.
Dalam kasus ion, yang tidak seperti atom memang memiliki muatan listrik, jumlah total elektron diperoleh dengan mengurangi jumlah atom kecuali beban ion, dengan segalanya dan tanda mereka.
Contoh
- Atom karbon (c) adalah elemen nomor 6 dari tabel periodik (yaitu nomor atomnya). Oleh karena itu, atom karbon memiliki total 6 elektron.
- Ion natrium (i) (na+) memiliki muatan positif +1, dan jumlah atom natrium adalah 11. Jadi jumlah total elektron ion ini adalah: 11 - (+1) = 10 elektron.
- Ion klorida (CL-) memiliki beban negatif -1, dan jumlah atom klorin adalah 17. Jadi jumlah total elektron ion ini adalah: 17 - ( - 1) = 17 + 1 = 18 elektron.
Jumlah elektron Valencia sama dengan kelompok mereka di tabel periodik
Unsur -unsur yang termasuk dalam kelompok 1a (logam alkali) semuanya memiliki 1 elektron valencia. Mereka yang termasuk 2 (alkaliner) memiliki 2, yang dari 3 (kelompok Boro, aluminium, gallium, dll.) Mereka memiliki 3 dan sebagainya. Ini tidak berlaku untuk logam transisi.
Seperti sebelumnya, ion dikurangi dari menghitung elektron valensi mereka.
Contoh
- Oksigen milik kelompok 6a untuk apa yang memiliki 6 elektron valensi.
- Ion sulfida (s2-) Ini juga milik kelompok 6a, tetapi memiliki beban -2, jadi ia memiliki: 6 -( -2) = 6 + 2 = 8 elektron valencia.
Contoh atom yang berbeda dan elektron internalnya
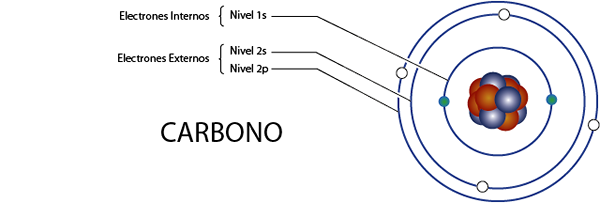
Elektron karbon internal (C)

Seperti yang kita lihat beberapa saat yang lalu, karbon memiliki total 6 elektron. Selain itu, itu milik Grup 4A untuk apa yang memiliki 4 elektron Valencia, jadi telah, secara total 6 - 4 = 2 elektron internal.
Elektron nitrogen internal (n)
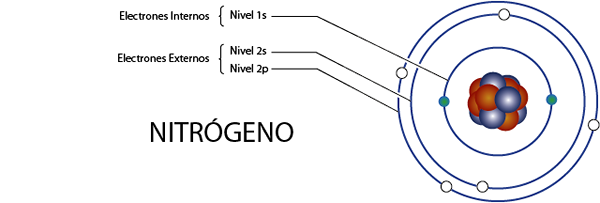
Nitrogen memiliki 7 elektron secara total. Selain itu, itu milik Grup 5A untuk apa yang memiliki 5 elektron Valencia, jadi, total 7 - 5 = 2 elektron internal.
Elektron internal Argon (AR)
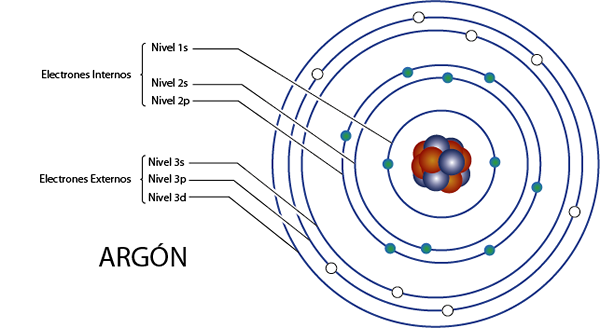
Argon adalah elemen 18 untuk total 18 elektron. Selain itu, itu milik Grup 8A untuk apa yang memiliki 8 elektron Valencia, jadi telah, total 18 - 8 = 10 elektron internal.
Elektron internal ion klorida (CL-)
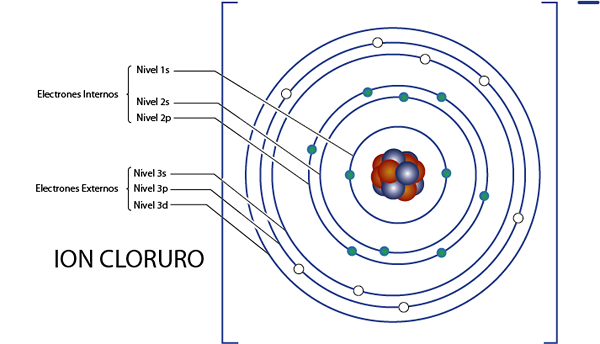
Seperti yang kita lihat beberapa saat yang lalu, klorida memiliki total 18 elektron. Selain itu, itu milik kelompok 7a dan memiliki beban -1, sehingga memiliki 7 - ( - 1) = 8 elektron valencia. Jadi memiliki 18 - 8 = 10 elektron internal, Seperti argon.
Ini dapat melayani Anda: Kimia Nuklir: Sejarah, Bidang Studi, Bidang, AplikasiElektron internal ion kalsium +2 (CA2+)
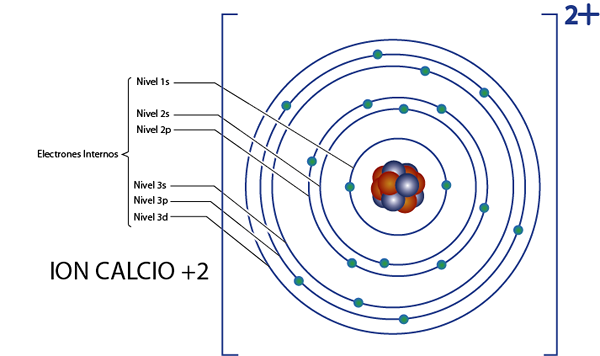
Kalsium adalah elemen 20, dan ion ini memiliki 2 muatan positif, sehingga memiliki total 20 - 2 = 18 elektron di sekitar nukleus. Elemen ini milik Grup 2A dan karena bebannya adalah +2, maka ia tidak memiliki elektron valensi (2 - 2 = 0). Untuk alasan ini, semua 18 elektron yang ditinggalkan oleh kalsium adalah yang awalnya elektron internal.
Ada dua elemen yang tidak memiliki elektron internal
Dua elemen yang lebih ringan dari tabel periodik, yaitu hidrogen (H) dan helium (HE), masing -masing memiliki 1 dan 2 elektron. Kedua elektron berada pada satu -satunya tingkat energi yang dimiliki atom -atom ini, yaitu level 1.
Karena alasan ini, elektron -elektron ini sesuai dengan elektron valensi dari dua elemen ini. Karena tidak ada tingkat energi yang lebih rendah, maka tidak ada elektron internal.

