Tautan Jembatan Hidrogen
- 4696
- 1295
- Domingo Gutkowski
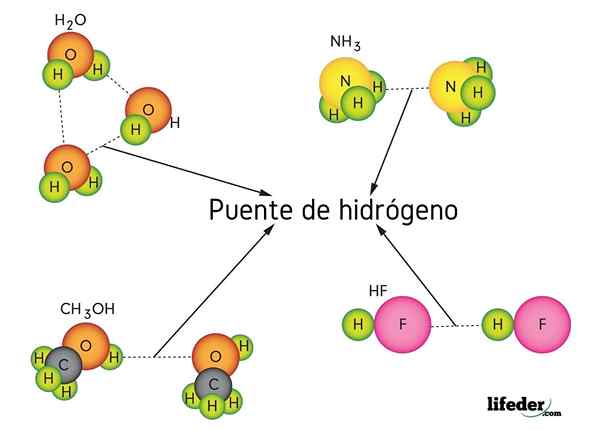
 Jembatan hidrogen dalam air (h2O), metanol (cho3OH), hidrogen fluoride (HF) dan amonia (NH3)
Jembatan hidrogen dalam air (h2O), metanol (cho3OH), hidrogen fluoride (HF) dan amonia (NH3) Apa itu tautan jembatan hidrogen?
Ikatan jembatan hidrogen adalah jenis khusus interaksi dipol-dipolo, milik gaya van der Waals, di mana atom hidrogen bergabung dengan dua atau lebih molekul tanpa dikaitkan secara kovalen. Tidak ada pembicaraan tentang kompartemen elektron, tetapi sebagian besar fenomena elektrostatik.
Seperti namanya, hidrogen bertindak sebagai jembatan, jadi harus antara dua atom. Hidrogen terkait (H-X) dengan atom yang sangat elektronegatif (seperti N, O dan F), dan mendekati atom elektronegatif lain tetapi dari molekul tetangga. Ini menghasilkan pembentukan jembatan hidrogen x ··· h-x.
Perhatikan bahwa dalam representasi x ··· h-x, titik-titik melambangkan jembatan hidrogen, sedangkan skrip mewakili ikatan kovalen antara H dan x. Yang mengatakan, mari kita lihat jembatan hidrogen di antara dua molekul air, di mana x adalah atom oksigen: h2Atau ··· H-OH (gambar bawah).
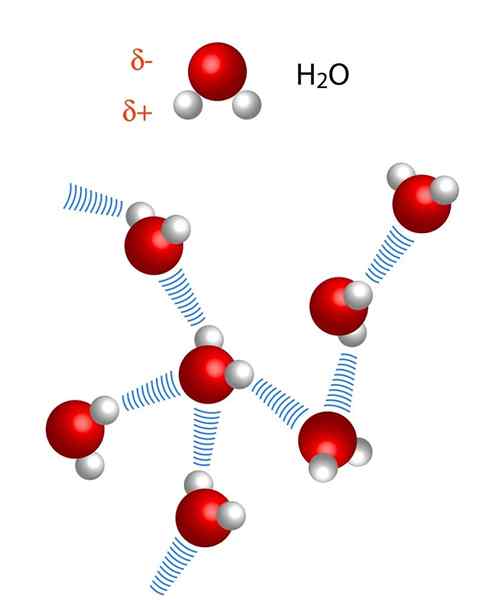
Pada gambar di atas kita melihat bahwa tujuh molekul air tetap bersama berkat jembatan hidrogen mereka, diwakili oleh garis biru. Jembatan hidrogen saja tidak terlalu kuat, tetapi ketika ada miliaran dari mereka, mereka memberikan masalah yang abnormal dan tidak terduga.
Karakteristik jembatan hidrogen
Komposisi
Jembatan hidrogen harus benar-benar direpresentasikan sebagai x '··· h-x, di mana x adalah apa yang dikenal sebagai donor jembatan hidrogen, karena secara kovalen terkait dengan hidrogen (memberikannya).
Sementara itu, X 'adalah akseptor jembatan hidrogen, hadir dalam molekul tetangga (menerimanya). Dengan demikian, kami memiliki atom donor (x), hidrogen (h) dan atom akseptor (x ') yang menyusun jembatan hidrogen (x' ··· h-x).
Geometris
Ketika kita memikirkan jembatan, permukaan datar atau melengkung muncul. Karena diasumsikan bahwa tautan tidak melengkung, kami kemudian akan memiliki dua jarak: x ··· h dan h-x, yang membentuk jembatan hidrogen x ··· h-x.
Dapat melayani Anda: reaksi ireversibel: karakteristik dan contohDi antara dua jarak ini ada sudut, yang sering kali 180 °; Yaitu, tiga atom jembatan kami beristirahat di garis horizontal (atau vertikal) yang sama.
Ketika sudut berbeda dari 180º, jembatan X ··· H-X tidak lagi lurus atau linier, tetapi memperoleh geometri lainnya.
Di sisi lain, jarak dalam jembatan hidrogen tidak identik. Jarak H-X lebih pendek dari x ··· h, yang dapat dilihat pada gambar molekul air. Jadi, misalnya, jarak h-x biasanya 110 pm (1 · 10-12m), sedangkan jarak lainnya x ··· h adalah 160 pm dan seterusnya.
Asosiatif
Karakteristik khusus dari jembatan hidrogen adalah bahwa ia memungkinkan molekul jauh lebih terkait satu sama lain. Mereka tidak berjalan dari sisi ke sisi lain. Oleh karena itu, ia menetapkan urutan sesaat di payudara cairan; Dan dalam kasus padatan, mereka berkontribusi pada definisi kristal mereka.
Di mana kita melihat jembatan hidrogen kita dapat memikirkan hubungan dan, oleh karena itu, dalam urutan tertentu (meskipun dinamis dan berubah) ke skala molekuler.
Energi
Melanggar jembatan hidrogen tidak terlalu sulit. Molekul air, misalnya, berjalan dan menciptakan setiap waktu saat memobilisasi. Tetapi melanggar banyak dari mereka pada saat yang sama akan menyiratkan gangguan jumlah molekul yang tak ada habisnya. Kami berbicara tentang memasok energi seperti itu yang mematahkan mol jembatan hidrogen ini (6.02 · 1023 X ··· h-x).
Dengan demikian, gaya jembatan hidrogen bervariasi tergantung pada identitas dan sifat molekul. Misalnya, gaya jembatan hidrogen atau ··· h-o antara air dan alkohol adalah 5 kkal/mol: 5 kkal energi diperlukan untuk memecahkan tahi lalat jembatan hidrogen yang dimaksud.
Dapat melayani Anda: Perubahan Kimia: Karakteristik, Contoh, JenisContoh jembatan hidrogen
Air
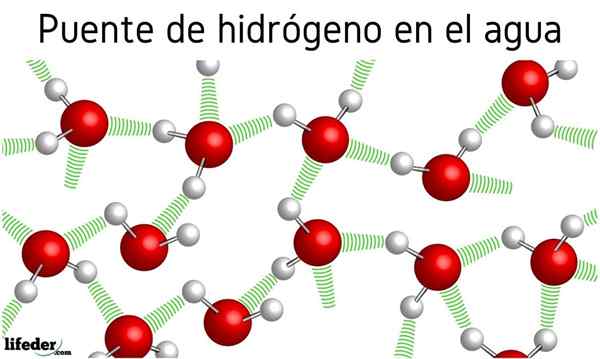
Pada awalnya ada pembicaraan tentang jembatan hidrogen di antara molekul air, tetapi efeknya terhadap sifatnya tidak disebutkan. Berkat mereka air mendidih pada suhu 100 ° C, meninggalkan titik mendidih molekul terkait seperti h2S, yang mendidih -60 ºC; atau h2Saya tahu, mendidih di -41.25 ºC.
Perbedaan buruk ini disebabkan oleh jembatan hidrogen air, yang juga mendefinisikan sifat anomali lainnya, seperti panas spesifiknya yang sangat besar, kristal es, konstanta dielektriknya, dll.
Etanol
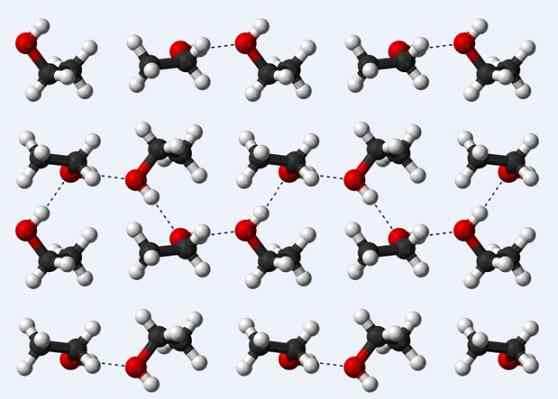 Jembatan hidrogen dalam kristal etanol
Jembatan hidrogen dalam kristal etanol Sekarang mari kita lihat jembatan hidrogen lain: yang antara molekul etanol, ch3Ch2Oh (di atas). Perhatikan bagaimana molekul ditampung3Ch2Oh sedemikian rupa sehingga jembatan hidrogen mereka ditetapkan3Ch2Ho ··· hoch2Ch3 (garis titik titik).
Namun, molekul terlalu diperintahkan untuk berasumsi bahwa kita berbicara tentang etanol cair, tetapi malah membuat gelas (etanol padat).
Jembatan hidrogen yang dijelaskan untuk etanol mirip dengan alkohol lainnya, dengan perbedaan bahwa kerangka berkarbonasi mereka dapat menghambat efisiensi jembatan tersebut.
Asam asetat
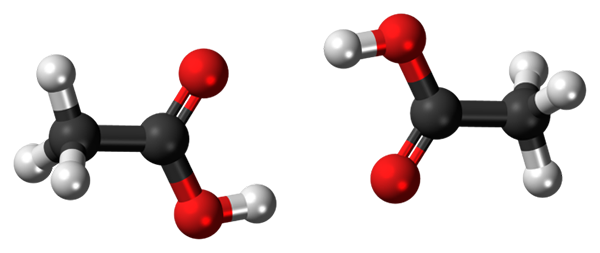 Jembatan hidrogen antara dua molekul asam asetat. Sumber: Jynto, CC0, via Wikimedia Commons
Jembatan hidrogen antara dua molekul asam asetat. Sumber: Jynto, CC0, via Wikimedia Commons Asam Asetat, Cho3COOH, mampu membangun dua jembatan hidrogen yang menyatukan dua molekul secara bersamaan. Karena mereka adalah dua molekul yang dihubungkan oleh jembatan hidrogen, kami berbicara tentang dimer.
Perhatikan bahwa salah satu jembatan hidrogen ini adalah C = O ··· H-O dan yang lainnya O-H ··· O = C. Asam asetat menyajikan kekhasan bahwa dalam fase uap itu ada seperti dimer ini.
Itu dapat melayani Anda: asam manganik atau permanganatSelulosa
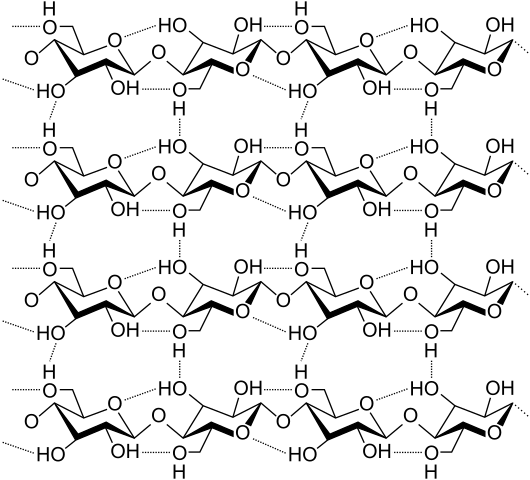 Jembatan hidrogen di antara beberapa rantai selulosa. Sumber: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons
Jembatan hidrogen di antara beberapa rantai selulosa. Sumber: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons Sekarang mari kita lihat jembatan hidrogen yang lebih beragam dan berganda. Selulosa, polimer alami, terdiri dari rantai yang terdiri dari beberapa unit β-glukosa.
Setiap rantai tetap ditetapkan untuk berkat banyak jembatan hidrogen (gambar superior), yang memperkuat kohesi antara rantai.
DNA
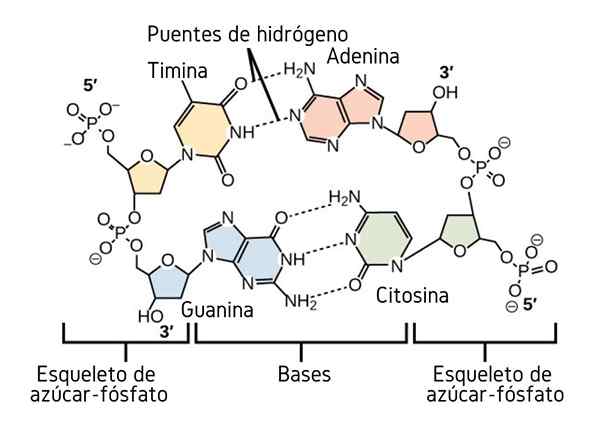 Jembatan hidrogen antara basis nitrogen DNA. Sumber: CNX OpenStax, CC oleh 4.0, via Wikimedia Commons
Jembatan hidrogen antara basis nitrogen DNA. Sumber: CNX OpenStax, CC oleh 4.0, via Wikimedia Commons Sejauh ini kita telah melihat efek asosiatif jembatan hidrogen untuk memaksakan urutan antara molekul. Tapi bagaimana dengan makromolekul? Dalam makromolekul, seperti DNA, kami menemukan jembatan hidrogen internal atau intramolekul antara timin, adenin, guanin dan sitosin (di atas) (di atas).
Jembatan hidrogen intramolekul antara pasangan basa nitrogen ini, membuat molekul DNA memperoleh struktur baling -baling ganda, yang sangat ideal untuk replikasinya. Jika jembatan hidrogen ini rusak dengan pemanasan, baling -baling ganda akan berakhir terbuka di dua segmen atau pita individu.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Edward e. Ávila & asilé j. Blackberry. (2004). Jembatan hidrogen dan link aplikasinya. Universitas Los Andes, Fakultas Ilmu Pengetahuan, Departemen Kimia.
- Wikipedia. (2020). Ikatan hidrogen. Diperoleh dari: di.Wikipedia.org
- Pietri J. & Clark J. (21 Agustus 2020). Ikatan hidrogen. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Para editor Eeritlopaedia Britannica. (2020). Ikatan hidrogen. Dipulihkan dari: Britannica.com
- Helmestine, Anne Marie, PH.D. (29 Oktober 2020). Apa contoh ikatan hidrogen? Pulih dari: thinkco.com

