Keseimbangan uap cair

- 3614
- 745
- Leland Robel
Apa itu keseimbangan uap cair?
Dia keseimbangan uap cair Ini adalah keadaan dinamis yang membentuk cairan, baik itu zat murni atau campuran, dengan uap yang mengelilingi dan berinteraksi dengan permukaannya. Untuk terjadi, wadah harus ditutup, jika tidak, arus udara akan menyebabkan cairan menguap secara perlahan.
Saat sistem ditutup, tekanan yang diberikan oleh molekul fase uap akan naik seiring berjalannya waktu. Suatu titik akan datang di mana tekanan akan berhenti; Ini adalah tekanan uap cairan, yang merupakan sifat fisik dari materi, yang tidak tergantung pada ukuran wadah, atau volume cairan.
 Saat minuman gas terbuka, keseimbangan uap cair terganggu, menyebabkan ketidakseimbangan tekanan di luar dan di dalam botol, dan dengan itu bubb. Sumber: OpenStax, CC oleh 4.0, via Wikimedia Commons
Saat minuman gas terbuka, keseimbangan uap cair terganggu, menyebabkan ketidakseimbangan tekanan di luar dan di dalam botol, dan dengan itu bubb. Sumber: OpenStax, CC oleh 4.0, via Wikimedia Commons Setiap cairan, murni atau dicampur, akan memiliki tekanan uap terkait yang akan tergantung pada volatilitas komponennya; Dan oleh karena itu, kekuatan antarmolekul yang menjaga mereka tetap bersama di dalam cairan dan di permukaannya.
Tekanan ini dapat dijelaskan dengan mengasumsikan idealitas solusi, atau ketidakmampuan komponen campuran. Untuk melakukan ini, penggunaan diagram biner sangat berguna, di mana dimungkinkan untuk merenungkan kelayakan proses pemisahan.
Keseimbangan uap cair sangat penting untuk infinitas proses rekayasa kimia, seperti distilasi fraksional dan yang dibuat dengan uap air, yang melaluinya disuling dalam komponen yang paling mudah menguap diperoleh. Ini adalah kasus etanol di 95.4% dalam air, menjadi persentase alkohol yang paling mudah diakses dan ekonomis di pasar.
Zat murni
Molekul zat murni tidak diam, tetapi berpindah dari satu tempat ke tempat lain berkat energi kinetik intrinsik. Energi ini kadang -kadang bisa cukup besar untuk mengatasi kekuatan antarmolekul yang "menarik" molekul dari khusus ke dada cairan. Kemudian, molekul akan keluar dari permukaan cairan ke fase uap.
Pada fase uap, molekul akan bertabrakan dengan dinding internal wadah, memenangkan atau kehilangan kecepatan sampai mereka bersatu kembali dengan permukaan cairan, di mana mereka pergi untuk mengintegrasikan konglomerat molekul fase cair fase cair cairan.
Dapat melayani Anda: kobalt: struktur, sifat, aplikasiDengan demikian, waktu berlangsung sampai, pada suhu tertentu (untuk mengatakan 25 ° C), jumlah molekul yang keluar dari permukaan sama dengan yang masuk dari uap. Oleh karena itu dikatakan bahwa keseimbangan uap cair telah ditetapkan dalam zat murni.
Tekanan uap untuk mengalami dinding internal wadah, serta permukaan cairan, akan sama dengan pKEº, yang konstan dan dapat direproduksi; Terlepas dari seberapa besar atau kecil wadah itu atau volume cairan yang dipertimbangkan.
Campuran
Dalam campuran cair juga akan ada komponen yang memberikan tekanan pada permukaan cair dan kontur wadah. Tekanan uap Anda, seperti yang dapat diharapkan, akan terdiri dari kontribusi dari masing -masing komponen campuran, untuk mengatakan, dua zat A dan B. Campuran ini bisa larut, sebagian larut.
Keliru
Dalam campuran yang larut antara A dan B, kedua zat membentuk satu fase, yang pada pandangan pertama terlihat seperti zat murni. Dengan demikian, menurut hukum Dalton, tekanan campuran atau solusi akan sama dengan:
Pmatahari = PKE + PB +··· Pyo
Menjadi pyo komponen lain apa pun yang juga ada dalam campuran. Perhatikan bahwa halKE≠ pKEº, yaitu, tekanan zat dalam campuran tidak sama dengan keadaan kemurnian tinggi mereka.
Ketika mengasumsikan bahwa solusinya sangat ideal, perbedaan antara interaksi A-A, B-B dan A-B jelas. Ini dapat diterapkan, misalnya, dalam campuran etanol dan metanol.
Oleh karena itu, tekanan uap komponen dalam campuran akan tergantung pada jumlah relatifnya dalam fase cair, dinyatakan sebagai fraksi molar xyo. Dan di sinilah hukum Rault mengintervensi, yang berupaya menghubungkan tekanan pKE Dan pKEº:
PKE = XKE PKEº
Sekarang tekanan total sama dengan:
Pmatahari = XKE PKEº + xB PBº +···
Fase uap, di sisi lain, akan memiliki komposisi sendiri, dinyatakan sebagai fraksi molar Yi:
Yi = pyo / Pmatahari
= Xyo Pyoº / pmatahari
Diagram biner
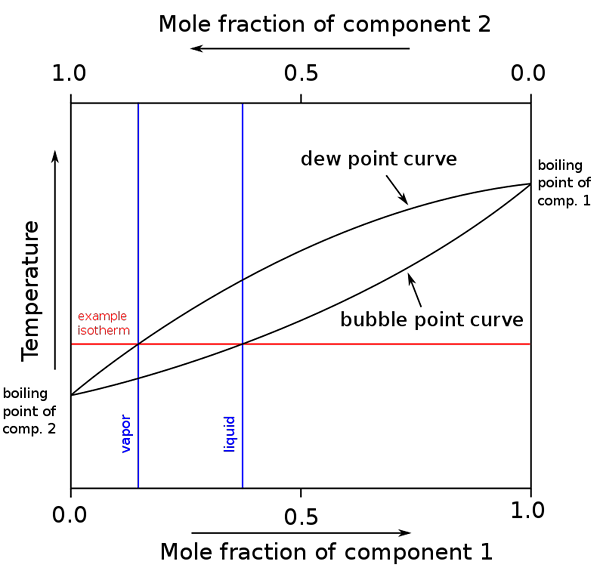 Diagram titik didih dan komposisi molar untuk campuran biner. Sumber: Binary_boiling_point_diagram.PNG: H PADLECKASDERIVATIF PEKERJAAN: MICHBICH, CC BY-SA 2.5, via Wikimedia Commons
Diagram titik didih dan komposisi molar untuk campuran biner. Sumber: Binary_boiling_point_diagram.PNG: H PADLECKASDERIVATIF PEKERJAAN: MICHBICH, CC BY-SA 2.5, via Wikimedia Commons Ketika fraksi molar dari komponen campuran biner (A + B) bersifat grafik, tergantung pada suhu atau tekanan, diagram biner diperoleh (lihat di atas). Bentuk khusus ini, yang paling sederhana, sesuai dengan solusi ideal.
Dapat melayani Anda: volume molar: konsep dan rumus, perhitungan dan contohArea di atas "oval" sesuai dengan fase uap, sedangkan area di bawah ini sesuai dengan fase cair campuran. Perhatikan bahwa ketika fraksi molar komponen 1 atau 0 (x1= 0), fraksi molar komponen 2 atau b akan sama dengan 1 (x2= 1), dan kemudian tekanan uap hanya berutang b. Suhu ini menjadi titik didih b.
Sementara itu, di ujung lain (kanan), saat x2= 0 tapi x1= 1, tekanan uap hanya. Suhu ini menjadi titik didihnya.
Garis oval yang lebih rendah sesuai dengan titik gelembung, yaitu ketika gelembung pertama muncul ketika campuran cairan dipanaskan (naikkan diagram). Dan garis atas sesuai dengan titik embun, yaitu saat fase uap mendingin dan tetesan pertama muncul (turun dalam diagram).
Azeotropos
Dalam banyak solusi non -ideal kita akan memiliki azeotrop, yang merupakan campuran yang menguap mempertahankan konstanta komposisi mereka; yaitu, mereka menguap seolah -olah mereka adalah senyawa murni.
Tidak mungkin untuk "memecahkan" komposisi azeotropik melalui langkah -langkah penyulingan yang lebih. Sebaliknya, metode lain digunakan untuk meningkatkan kemurnian komponen yang diinginkan.
Misalnya, campuran etanol-air membentuk azeotropik dengan komposisi 95.4 dari etanol. Ini berarti bahwa tidak mungkin, melalui distilasi, untuk mendapatkan etanol dengan konsentrasi yang lebih besar dari 95.4%; Akan selalu ada 4.6% air yang tersisa. Jika Anda ingin menyiapkan etanol absolut (100%), itu akan diminta untuk menggunakan bahan dehidrasi, atau rute sintesis lainnya.
Dalam diagram biner kita dapat melihat keberadaan azeotrope, yang menyajikan bentuk berikut:
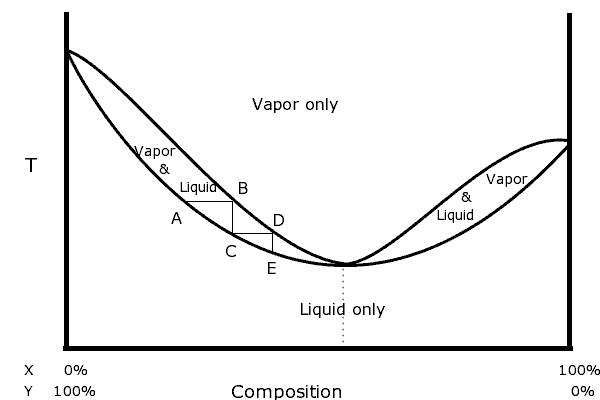 Diagram biner dari campuran dengan azeotropik positif. Sumber: Karlhahn di Inggris Wikipedia, domain publik, melalui Wikimedia Common
Diagram biner dari campuran dengan azeotropik positif. Sumber: Karlhahn di Inggris Wikipedia, domain publik, melalui Wikimedia Common Di sebelah kiri diagram dapat dilihat bahwa di dalam "oval", suatu daerah di mana kita memiliki keseimbangan uap cairan, kita dapat menyuling dalam langkah-langkah berturut-turut (A, B, C, D dan E) untuk mendapatkan yang semakin kaya kaya Campuran dalam komponen yang paling mudah menguap (x untuk diagram ini).
Namun, pada titik azeotropik, campuran x dan y dan rebus seolah -olah itu adalah zat tunggal, jadi tidak masalah berapa banyak distilasi yang dibuat, baik cairan dan uap akan memiliki komposisi yang sama.
Dapat melayani Anda: Formula Molekuler: Cara mengeluarkannya, contoh dan latihanSebagian larut
Dalam campuran sebagian larut mereka akan dibentuk, tergantung pada suhu, dua fase yang dapat dikenali: satu kaya dalam komponen A, dan lainnya kaya komponen B. Diagram biner untuk kasus -kasus ini lebih keras dan luas, karena melibatkan daerah di mana uap hidup bersama dengan dua fase.
Tidak terlihat
Saat berbicara tentang campuran yang tidak terlihat, setiap komponen akan berperilaku seolah -olah itu dalam keadaan kemurnian tinggi, karena hampir tidak berinteraksi dengan molekul lain. Oleh karena itu, tekanan uap untuk campuran ini akan sama dengan:
Pmatahari = PKEº + pBº +··· Pyoº
Campuran akan mendidih pada suhu yang lebih rendah dari komponen murni, karena tekanan campuran yang tidak terlihat akan lebih tinggi, karena sama dengan jumlah tekanan dari masing -masing komponen dalam keadaan murni. Lebih banyak tekanan uap menyiratkan bahwa itu lebih fluktuatif, dan karenanya akan mendidih pada suhu yang lebih rendah.
Aplikasi
Distilasi
Dalam distilasi, terutama di tingkat industri, pengetahuan tentang keseimbangan uap cair adalah yang utama. Dari komponen campuran, dan diagram fase, dapat dihitung berapa banyak hidangan yang diperlukan dalam konstruksi menara fraksinasi untuk pemisahan yang benar dari komponen tersebut.
Distilasi uap air
Uap air dapat dipompa di dalam campuran di bawah distilasi. Saat menggelegak uap air di dalam cairan, tekanan uap campuran akan ditingkatkan, sehingga akan mendidih pada suhu yang lebih rendah dan membantu mengekstrak komponen yang paling mudah menguap (seperti esensi).
Minum burung
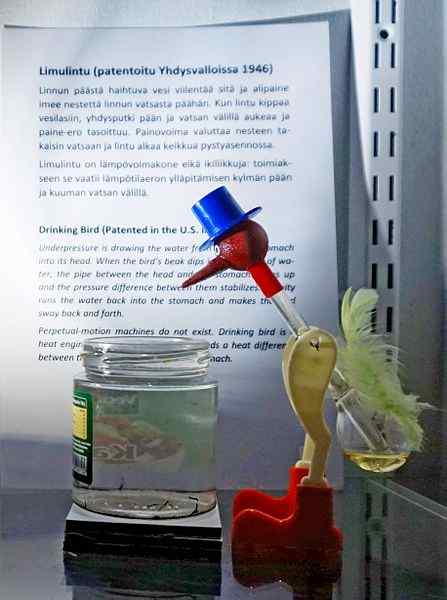 Minum burung, salah satu mainan paling cerdik sepanjang masa. Sumber: tiia monto, cc by-sa 4.0, via Wikimedia Commons
Minum burung, salah satu mainan paling cerdik sepanjang masa. Sumber: tiia monto, cc by-sa 4.0, via Wikimedia Commons Meskipun tidak justru keseimbangan uap cair, kebenarannya adalah bahwa di balik operasi burung minum beberapa fenomena termodinamika disembunyikan.
Saat kepala burung basah, itu mulai mendingin saat air menguap. Penurunan suhu ini menyebabkan penurunan tekanan di dalam kepala burung. Metilen klorida, yang terletak di dasar burung, akan berusaha menyeimbangkan tekanan, mengalir melalui tabung kaca yang menghubungkan kepala dengan kepala.
Cairan itu akan naik ke kepala burung, membuatnya lebih berat dan memiringkan tubuhnya ke depan. Burung itu kemudian "minum air" dan tekanan uap akan menyeimbangkan. Menyeimbangkan tekanan, burung burung akan kembali ke posisi vertikal dan siklus akan diulang saat air kepala menguap lagi.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Walter J. Moore. (1962). Kimia Fisik. (Edisi keempat). Longmans.
- Wikipedia. (2020). Keseimbangan uap-cair. Diperoleh dari: di.Wikipedia.org
- Ed Vitz et al. (5 November 2020). Keseimbangan uap-cair. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Limer Eric. (30 Januari 2018). Penjelasan rinci yang tidak masuk akal tentang mainan burung minum. Dipulihkan dari: Popularmechanics.com
- Universitas Alicante. (S.F.). Topik 4: Perhitungan uap keseimbangan. Diagram kesetimbangan. [PDF]. Pulih dari: rua.Ua.adalah

