Sifat skala mikroskopis, partikel penghitungan, contoh
- 2728
- 689
- Herbert Fritsch
Itu Skala mikroskopis Ini adalah salah satu yang digunakan untuk mengukur ukuran dan panjang yang tidak dapat dilihat dengan mata telanjang dan yang panjangnya di bawah milimeter. Dari yang lebih tinggi ke terendah, skala mikroskopis dalam sistem metrik adalah:
- Milimeter (1 mm), yang merupakan sepersepuluh sentimeter atau seperseribu satu meter. Dalam hal ini adalah skala kami memiliki salah satu sel terbesar di dalam tubuh, yang merupakan ovula, yang ukurannya 1,5mm.
 Gambar 1. Sel darah merah adalah sel skala mikroskopis. Sumber: Pixabay
Gambar 1. Sel darah merah adalah sel skala mikroskopis. Sumber: Pixabay - Kesepuluh milimeter (0,1 mm). Ini adalah skala ketebalan atau diameter rambut manusia.
- Mikrometer atau micra (1μm = 0,001mm). Pada skala ini adalah sel tanaman dan hewan dan bakteri.
Sel tanaman adalah urutan 100μm. Sel -sel hewan sepuluh kali kecil, itu dari urutan 10μm; Sedangkan bakteri 10 kali lebih sedikit dari sel hewan dan dari urutan 1μm.
[TOC]
Skala nanometrik
Bahkan ada langkah yang lebih kecil dari skala mikroskopis, tetapi itu biasanya tidak digunakan kecuali dalam beberapa konteks khusus. Selanjutnya kita akan melihat beberapa tindakan nanometrik terpenting:
- Nanometer (1 ηm = 0,001 μm = 0,000001 mm) adalah peringkat satu milimeter. Pada skala ini ada beberapa virus dan molekul. Virus adalah urutan 10ηm dan molekul urutan 1ηm.
- Angstrom (1å = 0,1ηm = 0,0001μm = 10-7mm). Ukuran ini membentuk skala atau ukuran atom.
- Fantometer (1FM = 0,00001å = 0,000001ηm = 10-12mm). Ini adalah skala inti atom, yang antara 10 ribu dan 100 ribu kali lebih kecil dari atom. Namun, meskipun ukurannya kecil, nukleus memusatkan 99,99% dari massa atom.
- Ada sisik yang lebih kecil ke inti atom, karena ini terdiri dari partikel seperti proton dan neutron. Tetapi ada lebih banyak: partikel -partikel ini pada gilirannya dibentuk oleh partikel yang lebih mendasar seperti quark.
Instrumen untuk observasi mikroskopis
Ketika objek berada di antara milimeter dan skala mikrometrik (1 mm - 0,001mm), mereka dapat diamati dengan mikroskop optik.
Namun, jika objek atau struktur berada di antara nanometer dan angstrom, maka mikroskop elektronik atau nanoskop akan diperlukan.
Dalam mikroskop elektronik alih -alih elektron energi tinggi digunakan yang memiliki panjang gelombang yang jauh lebih rendah dari cahaya. Kerugian mikroskop elektronik adalah bahwa itu tidak mungkin.
Dapat melayani Anda: Syok Magnetik: Unit, Rumus, Perhitungan, ContohDi sisi lain, cahaya laser digunakan dalam nanoskop, dan memiliki keunggulan dibandingkan mikroskop elektronik bahwa struktur dan molekul dapat dilihat dan direkam di dalam sel hidup.
Nanoteknologi adalah teknologi dengan sirkuit, struktur, suku cadang, dan bahkan mesin yang diproduksi pada skala mulai dari nanometer hingga skala atom.
Sifat mikroskopis
Dalam fisika, dalam pendekatan pertama perilaku materi dan sistem dipelajari dari sudut pandang makroskopis. Dari paradigma ini masalah ini adalah sebuah kontinum yang dapat dibagi tanpa batas; Dan sudut pandang ini valid dan memadai untuk banyak situasi kehidupan sehari -hari.
Namun, beberapa fenomena dunia makroskopis hanya memiliki penjelasan jika sifat mikroskopis materi diperhitungkan.
Dalam sudut pandang mikroskopis, struktur molekuler dan atom dari materi diperhitungkan. Berbeda dengan pendekatan makroskopis, pada skala ini ada struktur granular dengan lubang dan ruang antara molekul, atom dan bahkan di dalamnya.
Karakteristik lain dari sudut pandang mikroskopis dalam fisika, adalah bahwa sepotong materi tidak peduli seberapa kecil, terdiri dari sejumlah besar partikel yang terpisah satu sama lain dan dalam gerakan berkelanjutan.
-Materi adalah kekosongan yang sangat besar
Dalam pai kecil.
Artinya, sepotong materi pada skala mikroskopis adalah kekosongan besar dengan konsentrasi atom dan inti yang menempati fraksi yang sangat kecil dari total volume total. Dalam hal ini, skala mikroskopis memiliki kesamaan dengan skala astronomi.
Objek makroskopik untuk penemuan atom
Bahan kimia pertama, yang merupakan alkemis, menyadari bahwa bahan bisa dari dua jenis: murni atau senyawa. Ini mencapai gagasan elemen kimia.
Itu dapat melayani Anda: gradien tekanan: apa itu dan bagaimana itu dihitungUnsur kimia pertama ditemukan adalah tujuh logam kuno: perak, emas, besi, timah, timah, tembaga dan merkuri. Seiring waktu mereka ditemukan lebih sejauh zat ditemukan yang tidak bisa membusuk di tempat lain.
Kemudian elemen diklasifikasikan sesuai dengan sifat dan karakteristiknya dalam logam dan non -logam. Semua yang memiliki sifat kimia dan afinitas yang serupa.
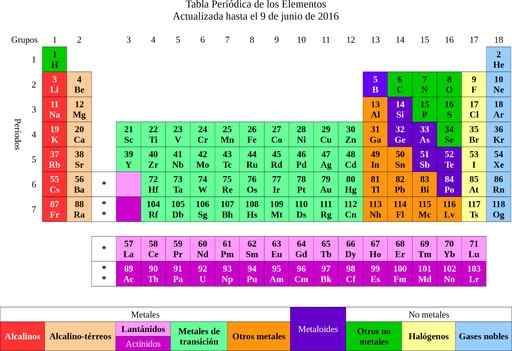 Gambar 2. Tabel Elemen Berkala. Sumber: Wikimedia Commons.
Gambar 2. Tabel Elemen Berkala. Sumber: Wikimedia Commons. Dari unsur -unsur itu masuk ke gagasan atom, kata yang berarti tidak terpisahkan. Beberapa saat kemudian para ilmuwan memperhatikan bahwa atom memang memiliki struktur. Selain itu atom memiliki dua jenis muatan listrik (positif dan negatif).
Partikel subatomis
Dalam percobaan Rutherford di mana ia membom atom -atom pelat emas tipis dengan partikel alfa, struktur atom terungkap: inti positif kecil dikelilingi oleh elektron.
Mereka terus membombardir atom -atom dari semakin banyak partikel energi dan masih dilakukan, untuk mengungkap rahasia dan sifat -sifat dunia mikroskopis semakin dalam skala yang lebih kecil.
Dengan cara ini, model standar tercapai, yang menetapkan bahwa partikel elementer sejati adalah model atom yang disusun. Pada gilirannya, atom memunculkan unsur -unsur, ini untuk senyawa dan semua interaksi yang diketahui (kecuali gravitasi). Total ada 12 partikel.
Partikel -partikel mendasar ini juga memiliki tabel periodiknya. Ada dua kelompok: partikel fermionik putaran ½ dan bosonik. Bosonik bertanggung jawab atas interaksi. Fermionik adalah 12 dan merupakan orang yang menimbulkan proton, neutron dan atom.
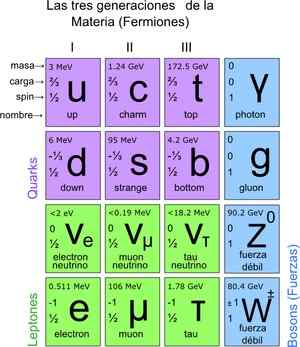 Gambar 3. Partikel mendasar. Sumber: Wikimedia Commons.
Gambar 3. Partikel mendasar. Sumber: Wikimedia Commons. Cara menghitung partikel pada skala mikroskopis?
Seiring waktu para ahli kimia menemukan massa relatif dari unsur -unsur dari pengukuran yang tepat dalam reaksi kimia. Misalnya, dapat ditentukan bahwa karbon 12 kali lebih berat dari hidrogen.
Juga ditentukan bahwa hidrogen adalah elemen paling ringan, sehingga elemen ini diberi massa relatif 1.
Di sisi lain, bahan kimia diperlukan untuk mengetahui jumlah partikel yang terlibat dalam suatu reaksi, sehingga tidak ada reagen yang hilang. Misalnya molekul air membutuhkan dua atom hidrogen dan satu oksigen.
Dapat melayani Anda: fenomena bergelombangDari latar belakang ini konsep mol lahir. Satu mol zat apa pun adalah jumlah partikel tetap yang setara dengan massa molekul atau atomnya dalam gram. Dengan demikian ditentukan bahwa 12 gram karbon memiliki jumlah partikel yang sama dengan 1 gram hidrogen. Angka itu dikenal sebagai angka Avogadro: 6.02 x 10^23 partikel.
-Contoh 1
Hitung berapa banyak atom emas dalam 1 gram emas.
Larutan
Diketahui bahwa emas memiliki berat atom 197. Data ini dapat ditemukan dalam tabel periodik dan menunjukkan bahwa atom emas 197 kali lebih berat dari satu hidrogen dan 197/12 = 16.416 kali lebih berat dari karbon.
Mol emas memiliki atom 6,02 × 10^23 dan memiliki berat atom yang diekspresikan dalam gram, yaitu 197 gram.
Dalam gram emas ada 1/197 mol emas, yaitu 6,02 × 10^23átomos/197 = 3.06 x10^23 atom emas.
-Contoh 2
Tentukan jumlah molekul kalsium karbonat (CACO3) bahwa ada dalam 150 gram zat ini. Juga katakan berapa banyak atom kalsium, berapa banyak karbon dan berapa banyak oksigen yang ada di senyawa ini.
Larutan
Hal pertama adalah menentukan massa molekul kalsium karbonat. Tabel periodik menunjukkan bahwa kalsium memiliki berat molekul 40 g/mol, karbon 12 g/mol dan oksigen 16 g/mol.
Kemudian massa molekul (caco3) menjadi :
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Setiap 100 gram kalsium karbonat adalah 1mol. Kemudian dalam 150 gram sesuai dengan 1,5 mol.
Setiap mol karbonat memiliki molekul karbonat 6,02 x 10^23, jadi dalam 1,5 mol karbonat ada 9,03 x 10^23 molekul.
Meringkas, dalam 150 gram kalsium karbonat ada:
- 9.03 x 10^23 Molekul kalsium karbonat.
- Atom kalsium: 9.03 x 10^23 .
- Juga 9.03 x 10^23 atom karbon
- Akhirnya, 3 x 9,03 x 10^23 atom oksigen = 27,09 x 10^23 atom oksigen.
Referensi
- Biologi Terapan. Apa saja langkah -langkah mikroskopis?. Dipulihkan dari: YouTube.com
- Pendidikan Kimia. Representasi makroskopis, submikroskopis dan simbolis pada materi. Pulih dari: scielo.org.MX.
- Garcia a. Kursus Fisika Interaktif. Makro -Status, Microstates. Suhu, entropi. Diperoleh dari: sc.Ehu.adalah
- Struktur materi mikroskopis. Pulih dari: alipso.com
- Wikipedia. Tingkat mikroskopis. Pulih dari: wikipedia.com

