Spektrum serapan
- 1312
- 303
- Frederick Pfeffer
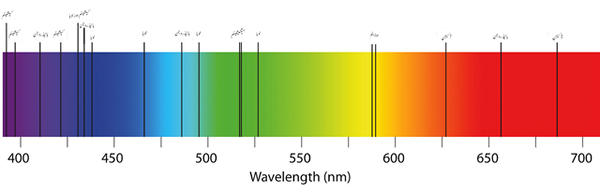
 Spektrum cahaya yang terlihat. Sumber: Wikimedia Commons
Spektrum cahaya yang terlihat. Sumber: Wikimedia Commons Apa itu spektrum penyerapan?
A Spektrum serapan Ini adalah produk dari interaksi cahaya dengan material atau zat di salah satu keadaan fisiknya. Interaksi mencakup segmen luas dari kisaran panjang gelombang dan energi radiasi elektromagnetik.
Dengan kata lain, spektrum serapan mencerminkan bahwa fraksi radiasi elektromagnetik yang diserap oleh bahan tertentu dalam rentang frekuensi.
Dalam pengertian ini, beberapa padatan, cairan atau gas dapat menyerap foton energi atau panjang gelombang yang berbeda, dari radiasi ultraviolet, diikuti oleh cahaya yang terlihat, hingga radiasi atau cahaya inframerah, mengejutkan dalam panjang gelombang gelombang mikrowave microwave.
Mata manusia hanya merasakan interaksi materi dengan cahaya yang terlihat. Ia juga mampu merenungkan difraksi cahaya putih melalui prisma atau media dalam komponen berwarna -warni (gambar superior).
Jika sinar cahaya "tangkap" setelah melakukan perjalanan melalui suatu bahan, dan dianalisis, tidak adanya pita berwarna tertentu akan ditemukan. Artinya, garis -garis hitam akan diamati kontras dengan latar belakangnya.
Ini adalah spektrum penyerapan, dan analisisnya sangat mendasar dalam kimia analitik instrumental dan astronomi.
Penyerapan atom
Pada gambar atas spektrum serapan khas dari elemen atau atom ditampilkan. Perhatikan bahwa garis -garis hitam mewakili panjang gelombang yang diserap, sementara yang lain dipancarkan. Ini berarti bahwa, sebaliknya, spektrum siaran atom akan terlihat seperti pita hitam dengan warna yang dipancarkan.
Tapi apa garis -garis itu? Bagaimana mengetahui apakah atom menyerap atau memancarkan (tanpa memperkenalkan fluoresensi atau fosfor)? Jawabannya ada di keadaan elektronik yang diizinkan oleh atom.
Dapat melayani Anda: Formula Minimum: Cara Mendapatkan Formula Minimum, Contoh dan LatihanTransisi dan energi elektronik
Elektron dapat pindah dari nukleus, membuatnya dimuat secara positif saat bepergian dari orbital energi yang lebih rendah ke salah satu energi yang lebih besar. Untuk melakukan ini, dijelaskan oleh fisika kuantum, menyerap foton energi spesifik untuk melakukan transisi elektronik tersebut.
Oleh karena itu, energi dikuantisasi, dan tidak akan menyerap medium atau tiga perempat foton, tetapi nilai frekuensi (ν) atau panjang gelombang beton (λ).
Setelah elektron bersemangat, itu tidak tetap tidak terbatas dalam keadaan elektronik energi yang lebih besar. Lepaskan energi dalam bentuk foton, dan atom kembali ke keadaan basal atau aslinya.
Bergantung pada apakah foton yang diserap direkam, akan ada spektrum penyerapan. Dan jika foton yang dikeluarkan direkam, maka hasilnya akan menjadi spektrum emisi.
Fenomena ini dapat diamati secara eksperimental jika sampel lunak atau atom dipanaskan dari suatu elemen. Dalam astronomi, membandingkan spektrum ini, komposisi bintang dapat diketahui, dan bahkan lokasinya terkait dengan bumi.
Spektrum yang terlihat
Seperti dapat dilihat pada gambar, spektrum yang terlihat mencakup warna dari violet ke merah dan semua nuansa sehubungan dengan seberapa banyak bahan yang diserap (nuansa gelap).
Panjang gelombang lampu merah sesuai dengan nilai 650 nm dan seterusnya (sampai menghilang dalam radiasi inframerah).
Dan di ujung kiri, nada ungu dan ungu menutupi nilai panjang gelombang hingga 450 nm. Spektrum yang terlihat kemudian mencakup dari 400 hingga sekitar 700 nm.
Ketika λ meningkat, frekuensi foton berkurang, dan, oleh karena itu, energinya. Dengan demikian, cahaya violet memiliki energi yang lebih besar (panjang gelombang yang lebih rendah) daripada cahaya merah (panjang gelombang yang lebih tinggi).
Dapat melayani Anda: bromin: riwayat, struktur, konfigurasi elektronik, properti, penggunaanOleh karena itu, bahan yang menyerap cahaya ungu menyiratkan transisi elektronik dari energi yang lebih besar.
Saat bahan menyerap warna ungu, ia akan mengenakan warna kuning kehijauan, yang berarti elektronnya melakukan transisi energi yang sangat. Dan ketika bahan menyerap warna merah, lebih sedikit energi, itu akan mencerminkan warna hijau kebiruan.
Ketika sebuah atom sangat stabil, biasanya menyajikan keadaan elektronik yang sangat jauh dalam energi, dan dengan demikian perlu menyerap foton energi yang lebih besar untuk memungkinkan transisi elektronik:
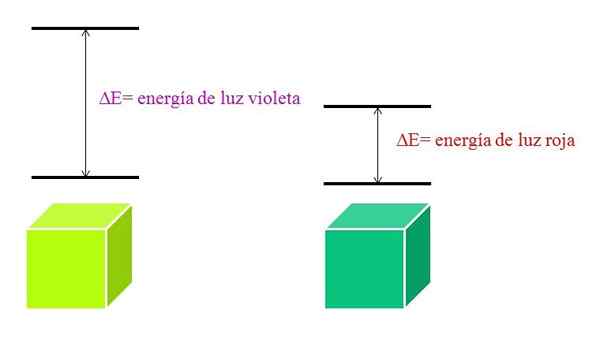 Skema Energi Lampu Violet dan Lampu Merah. Sumber: Gabriel Bolívar
Skema Energi Lampu Violet dan Lampu Merah. Sumber: Gabriel Bolívar Spektrum penyerapan molekul
Molekul memiliki atom, dan ini juga menyerap radiasi elektromagnetik. Namun, elektron mereka adalah bagian dari ikatan kimia, jadi transisi mereka berbeda. Salah satu kemenangan besar teori orbital molekuler adalah untuk dapat menghubungkan spektrum penyerapan dengan struktur kimia.
Dengan demikian, tautan sederhana, ganda, tiga, terkonjugasi, dan struktur aromatik, memiliki keadaan elektronik sendiri, menyerap foton yang sangat spesifik.
Dengan memiliki beberapa atom, selain interaksi antarmolekul dan getaran hubungan mereka (yang juga menyerap energi), spektrum serapan molekul memiliki bentuk "gunung", yang menunjukkan pita yang mencakup panjang gelombang di mana transisi elektronik elektronik.
Berkat spektrum ini, senyawa dapat dikarakterisasi, mengidentifikasi, dan bahkan melalui analisis multivariat, mengukurnya.
Methylene Blue
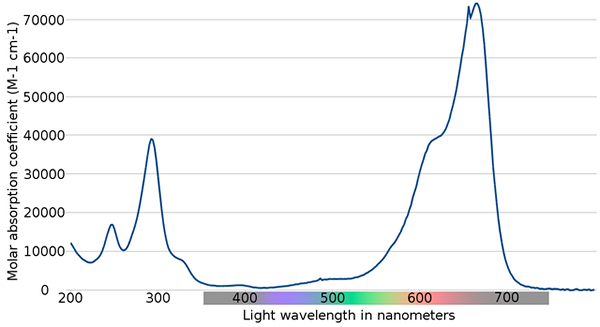 Spektrum biru metilen. Sumber: Wikimedia Commons
Spektrum biru metilen. Sumber: Wikimedia Commons Pada gambar atas spektrum indikator metilen biru ditampilkan. Seperti namanya, berwarna biru, tetapi dapat diperiksa dengan spektrum penyerapannya?
Dapat melayani Anda: perubahan fisikPerhatikan bahwa ada pita antara panjang gelombang 200 dan 300 nm. Antara 400 dan 500 nm hampir tidak ada penyerapan, yaitu, ia tidak menyerap warna ungu, biru atau hijau.
Namun, ia menyajikan pita penyerapan yang intens setelah 600 nm, dan, oleh karena itu, memiliki transisi elektronik energi rendah yang menyerap foton lampu merah.
Akibatnya, dan diberi nilai tinggi penyerapan molar, metilen biru menunjukkan warna biru yang intens.
Klorofil A dan B
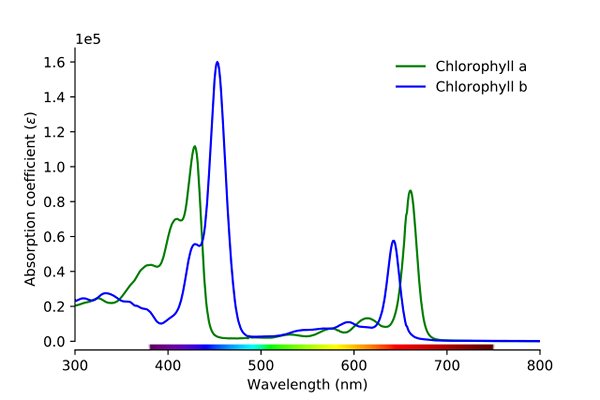 Spektrum penyerapan klorofil A dan B. Sumber: Wikimedia Commons
Spektrum penyerapan klorofil A dan B. Sumber: Wikimedia Commons Seperti dapat dilihat pada gambar, garis hijau sesuai dengan spektrum serapan klorofil, sedangkan garis biru sesuai dengan klorofil B B.
Pertama, pita di mana absorbitas molar lebih tinggi, dalam hal ini, yang ada di sebelah kiri, antara 400 dan 500 nm. Klorofil A yang sangat menyerap warna ungu, sedangkan klorofil B (garis biru) melakukannya dengan warna biru.
Dengan menyerap klorofil B sekitar 460 nm (biru), warna kuning tercermin. Di sisi lain, itu juga menyerap intens, sekitar 650 nm, cahaya oranye, yang berarti menunjukkan warna biru. Jika kuning dan biru dicampur, itu menghasilkan warna hijau.
Dan akhirnya, klorofil menyerap warna violet kebiruan, dan juga, lampu merah sekitar 660 nm. Oleh karena itu, ia menunjukkan warna "lembut" hijau dengan kuning.
Referensi
- Observatoire de Paris (s.F.). Berbagai jenis spektrum. Diperoleh rata -rata4.OSPPM.fr
- Kampus Universitas Ranals (s.F.). Spektrofometri: Spektrum serapan dan kuantifikasi kolorimetri biomolekul. UCO pulih.adalah

