Struktur Kuarter Karakteristik Protein

- 2099
- 270
- Ray Thiel
Itu Struktur Kuarter protein mendefinisikan hubungan spasial antara masing -masing subunit polipeptida yang dihubungkan oleh kekuatan non -kovalen. Dalam protein polimer, masing -masing rantai polipeptida yang mengada -ada disebut subunit atau protomer.
Protein dapat dibentuk oleh satu (monomerik), dua (dimérica), beberapa (oligomer) atau banyak protomer (polimer). Protomer ini dapat memiliki struktur molekul yang serupa atau sangat berbeda di antara mereka. Dalam kasus pertama dikatakan bahwa mereka adalah protein homotipik dan dalam kasus kedua, heterotipikal.
 Contoh struktur kuaterner protein antigen nuklir sel proliferasi. Diambil dan diedit dari: Thomas Shafee [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)].
Contoh struktur kuaterner protein antigen nuklir sel proliferasi. Diambil dan diedit dari: Thomas Shafee [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)]. Dalam notasi ilmiah, ahli biokimia menggunakan huruf -huruf Yunani dengan subskrip untuk menggambarkan komposisi protomer protein. Misalnya, protein homotipik tetramerik ditetapkan sebagai α4, Sedangkan protein tetramerik yang dibentuk oleh dua dimer yang berbeda ditetapkan sebagai α2β2.
[TOC]
Struktur protein
Protein adalah molekul kompleks yang memperoleh konfigurasi tiga dimensi yang berbeda. Konfigurasi ini eksklusif untuk setiap protein dan memungkinkan mereka melakukan fungsi yang sangat spesifik. Tingkat organisasi struktural protein adalah sebagai berikut.
Struktur utama
Itu mengacu pada urutan di mana asam amino yang berbeda dalam rantai polipeptida disusun. Urutan ini diberikan oleh urutan DNA yang mengkode protein tersebut.
Struktur sekunder
Sebagian besar protein bukan rantai panjang asam amino yang sepenuhnya diperpanjang, tetapi memiliki daerah yang secara teratur dilipat dalam bentuk baling -baling atau lembaran. Lipat ini adalah yang disebut struktur sekunder.
Struktur tersier
Area terlipat dari struktur sekunder dapat, pada gilirannya, melipat dan merakit dalam struktur yang lebih kompak. Lipatan terakhir ini adalah yang memberikan protein bentuk tiga dimensi.
Struktur Kuarter
Dalam protein yang dibentuk oleh lebih dari satu subunit, struktur kuaterner adalah hubungan spasial yang ada antara masing -masing subunit, yang dihubungkan oleh ikatan non -kovalen.
Dapat melayani Anda: bagaimana jamur bernafas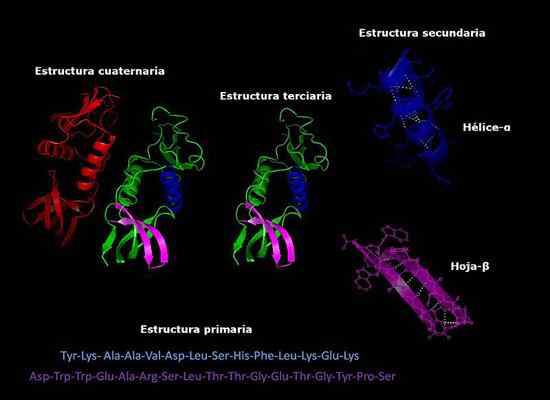 Struktur protein primer, sekunder, tersier dan kuaterner, konformasi tiga dimensi. Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)].
Struktur protein primer, sekunder, tersier dan kuaterner, konformasi tiga dimensi. Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Stabilitas struktur kuaterner
Struktur protein tiga dimensi distabilkan oleh interaksi yang lemah atau non -kovalen. Sementara tautan atau interaksi ini jauh lebih lemah dari ikatan kovalen normal, ini banyak dan efek kumulatifnya sangat kuat. Selanjutnya kita akan melihat beberapa interaksi yang paling umum.
Interaksi hidrofobik
Beberapa asam amino mengandung rantai samping hidrofobik. Ketika protein memiliki asam amino ini, lipatan molekul memesan rantai lateral ini ke dalam protein dan melindunginya dari air. Sifat rantai samping yang berbeda menyebabkan mereka berkontribusi dengan cara yang berbeda dalam efek hidrofobik.
Interaksi van der waals
Interaksi ini terjadi ketika molekul atau atom yang tidak disatukan oleh ikatan kovalen terlalu banyak mendekati di antara mereka, dan karena itu orbital elektronik terluar mulai tumpang tindih.
Pada saat itu gaya tolakan ditetapkan di antara atom -atom ini yang tumbuh sangat cepat dengan perkiraan pusat masing -masing. Ini adalah SO yang disebut van der Waals "kekuatan".
Interaksi beban beban
Itu adalah interaksi elektrostatik yang terjadi antara beberapa partikel yang dimuat. Dalam protein jenis interaksi ini terjadi, baik karena muatan listrik bersih dari protein, dan beban individu ion yang terkandung di dalam. Jenis interaksi ini kadang -kadang disebut Puente Salino.
Ikatan hidrogen
Ikatan hidrogen ditetapkan antara atom hidrogen yang melekat, dengan cara.
Jenis ikatan ini sangat penting, karena sifat -sifat banyak molekul, termasuk air dan molekul biologis, sebagian besar disebabkan oleh ikatan hidrogen. Berbagi sifat obligasi kovalen (elektron dibagikan) dan juga interaksi non-kovalen (interaksi beban kargo).
Dapat melayani Anda: tanaman sementaraInteraksi dipolos
Dalam molekul, termasuk protein, yang tidak menghadirkan beban bersih, disposisi yang tidak unik dari beban internal mereka dapat diserahkan, dengan ujung yang sedikit lebih negatif dari yang lain. Inilah yang dikenal sebagai dipol.
Kondisi dipol molekul ini bisa menjadi permanen, tetapi juga dapat diinduksi. Dipolo dapat tertarik pada ion atau dipol lainnya. Jika dipolnya permanen, interaksi memiliki ruang lingkup yang lebih besar daripada yang disajikan dengan dipol yang diinduksi.
Selain interaksi non -kovalen ini, beberapa protein oligomer menstabilkan struktur kuaterner mereka dengan menggunakan jenis tautan kovalen, tautan disulfida. Ini ditetapkan antara gugus sulfhidrillo dari sisteon protomer yang berbeda.
Ikatan disulfuro juga membantu menstabilkan struktur sekunder protein, tetapi dalam hal ini, limbah sistein terhubung di dalam polipeptida yang sama (intrapopolipeptide disulfide link).
Interaksi antar protomer
Seperti disebutkan sebelumnya, dalam protein yang terdiri dari beberapa subunit atau protomer, subunit ini bisa serupa (homotip) atau berbeda (heterotipikal).
Interaksi homotypic
Subunit yang membentuk protein adalah rantai polipeptida asimetris. Namun, dalam interaksi homotipik, subunit ini dapat dikaitkan dengan berbagai cara mencapai berbagai jenis simetri.
Kelompok yang berinteraksi dengan masing -masing protomer umumnya terletak di posisi yang berbeda, sehingga mereka disebut interaksi heterolog. Interaksi heterolog antara subunit yang berbeda, kadang -kadang terjadi sedemikian rupa sehingga setiap subunit bengkok sehubungan dengan preseden, struktur heliks dan struktur heliks dapat dicapai.
Pada kesempatan lain, interaksi diberikan sedemikian rupa sehingga kelompok subunit yang ditentukan diatur di sekitar satu atau beberapa sumbu simetri, dalam apa yang dikenal sebagai simetri titik -kelompok. Ketika ada beberapa sumbu simetri, setiap subunit dipecah sehubungan dengan tetangga 360 °/N (di mana N mewakili jumlah sumbu).
Itu dapat melayani Anda: flora dan fauna Australia: spesies representatifDi antara jenis simetri yang diperoleh dengan cara ini adalah misalnya, heliks, kubik dan icosahedral.
Ketika dua subunit berinteraksi melalui sumbu biner, setiap unit rusak 180 ° sehubungan dengan yang lain, di sekitar sumbu itu. Simetri ini dikenal sebagai Simetri C2. Di dalamnya, situs interaksi di setiap subunit identik; Dalam hal ini tidak ada pembicaraan tentang interaksi heterolog, tetapi interaksi isolog.
Jika, sebaliknya, hubungan antara dua komponen dimer adalah heterolog, maka dimer asimetris akan diperoleh.
Interaksi heterotipik
Tidak selalu subunit yang berinteraksi dalam protein memiliki sifat yang sama. Ada protein yang dibentuk oleh dua belas atau lebih banyak subunit yang berbeda.
Interaksi yang mempertahankan stabilitas protein sama seperti dalam interaksi homotipik, tetapi molekul asimetris yang sama sekali umumnya diperoleh.
Hemoglobin, misalnya, adalah penguji yang menyajikan dua pasang subunit yang berbeda (α2β2).
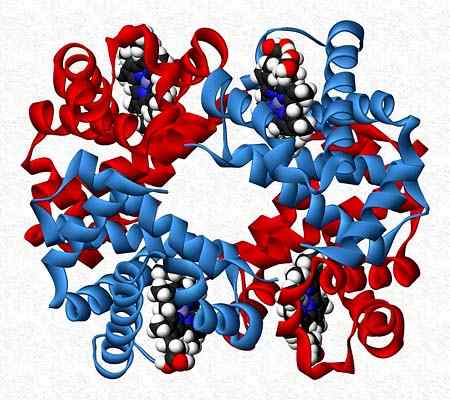 Struktur Kuarter Hemoglobin. Diambil dan diedit dari: benjah-bmm27. Dimodifikasi oleh alejandro porto. [CC0].
Struktur Kuarter Hemoglobin. Diambil dan diedit dari: benjah-bmm27. Dimodifikasi oleh alejandro porto. [CC0]. Referensi
- C.K. Mathews, k.DAN. Van Hold & K.G. Ahern (2002). Biokimimia. Edisi ke -3. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, hlm. Mayes, d.C. Granner & v.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biokimimia. Edisi ke -5. W. H. Freeman and Company.
- J. Koolman & k.-H. Roehm (2005). Atlas dari warna biokimia. Edisi ke -2. Thieme.
- KE. Lehninger (1978). Biokimia. Edisi omega, s.KE.
- L. Stryer (1995). Biokimimia. W.H. Freeman and Company, New York.
- « Abad ke -19 dalam populasi Chili, masyarakat, ekonomi dan politik
- Karakteristik Vimentin, Struktur, Fungsi dan Penggunaan »

