Struktur sekunder protein karakteristik

- 2247
- 327
- Pete Lesch
Itu Struktur protein sekunder Itu adalah nama yang mendefinisikan konformasi yang dilipat secara lokal dari beberapa bagian rantai polipeptida. Struktur ini terdiri dari beberapa pola yang diulang secara teratur.
Ada banyak cara di mana rantai protein dilipat. Namun, hanya beberapa bentuk ini yang sangat stabil. Di alam, bentuk paling sering yang diperoleh protein adalah baling -baling α serta β sheet. Struktur ini dapat dijelaskan dengan sudut tautan ψ (Psi), dan φ (Phi) limbah asam amino.
 Skema dan model bola dan batang alfa helix protein (struktur sekunder). Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)].
Skema dan model bola dan batang alfa helix protein (struktur sekunder). Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Interaksi yang ditetapkan antara rantai lateral limbah asam amino dapat membantu menstabilkan atau, sebaliknya, mengacaukan struktur sekunder protein. Struktur sekunder dapat diamati dalam konstitusi banyak protein berserat.
[TOC]
Sejarah
Pada dekade 30 -an abad terakhir, William Atsbury, bekerja dengan X -rays, menemukan bahwa protein rambut, serta paku lonjakan landak, yang dimiliki dalam segmen struktur mereka yang diulang secara teratur.
Berdasarkan hasil ini, dan dengan pengetahuan tentang pentingnya ikatan hidrogen dalam orientasi kelompok kutub dari ikatan peptida, William Pauling dan kolaborator, akibatnya mereka menentukan secara hipotetis kemungkinan konformasi reguler yang dapat dimiliki protein yang dapat dimiliki oleh protein.
Pauling dan kolaboratornya, pada 1950 -an, mendirikan beberapa dalil yang harus dipenuhi dalam hubungan rantai polipeptida, termasuk, dan pertama -tama, bahwa dua atom tidak dapat saling mendekati pada jarak yang lebih rendah dari jarak mereka masing -masing dari masing -masing dari masing -masing dari mereka masing -masing masing -masing dari mereka masing -masing masing radio van der Waals.
Mereka juga menunjukkan bahwa tautan non -kovalen diperlukan untuk menstabilkan lipatan rantai.
Dapat melayani Anda: reproduksi seksualBerdasarkan postulat ini dan pengetahuan sebelumnya, dan menggunakan model molekuler, mereka berhasil menggambarkan beberapa konformasi protein secara teratur, termasuk, yang kemudian menunjukkan bahwa mereka adalah yang paling sering di alam, seperti baling -baling α dan lamina β β β.
Baling -baling α
Ini adalah struktur sekunder paling sederhana, di mana rantai polipeptida disusun dalam bentuk yang digulung dan dipadatkan di sekitar sumbu imajiner. Selain itu, rantai samping masing -masing asam amino menonjol dari kerangka heliks ini.
Asam amino, dalam hal ini, disusun sedemikian rupa sehingga mereka memiliki sudut tautan ψ Dari -45 ° hingga -50 °, dan φ -60 °. Sudut -sudut ini merujuk pada hubungan antara karbon α dan oksigen karbonil dan ikatan antara nitrogen dan karbon α dari masing -masing asam amino, masing -masing.
Selain itu, para ilmuwan telah menentukan bahwa untuk setiap belokan baling -baling α, 3,6 limbah asam amino disajikan dan bahwa pergantian ini selalu dekstrogyri dalam protein. Selain menjadi struktur paling sederhana, baling-baling α adalah bentuk dominan dalam α-queratinas dan sekitar 25% dari asam amino protein globular mengadopsi struktur ini.
Baling -baling α distabilkan berkat fakta bahwa itu menyajikan banyak jembatan hidrogen. Dengan demikian, tiga atau empat tautan jenis ini ditetapkan di setiap giliran baling -baling.
Dalam jembatan hidrogen, nitrogen ikatan peptida dan atom oksigen dari gugus karbonil dari asam amino berikutnya berinteraksi, ke arah sisi terminal amino dari rantai itu.
Para ilmuwan telah menunjukkan bahwa baling-baling α dapat dibentuk dengan rantai polipeptida yang dibentuk oleh asam L- atau D-amino, dengan kondisi bahwa semua asam amino memiliki konfigurasi stereoisomera yang sama. Selain itu, asam l-amino alami dapat membentuk α droord dengan kedua kanan dan kiri.
Dapat melayani Anda: imunoglobulin DNamun, tidak semua polipeptida dapat membentuk baling -baling α yang stabil, karena struktur utamanya mempengaruhi stabilitas ini. Rantai R dari beberapa asam amino dapat mengacaukan struktur, mencegah pembentukan baling -baling α.
Β sheet
Dalam lembaran β, atau lembaran β terlipat, masing -masing limbah asam amino memiliki rotasi 180 ° sehubungan dengan residu asam amino sebelumnya. Dengan cara ini, diperoleh sebagai akibat dari kerangka rantai polipetid diperpanjang dan dalam bentuk zig -zag atau akordeon.
Rantai polipeptida berbentuk chord berpenaga dapat ditempatkan berdekatan satu sama lain dan menghasilkan jembatan hidrogen linier di antara kedua rantai.
Dua rantai polipeptida yang berdekatan dapat diatur secara paralel, yaitu, keduanya dapat berorientasi pada arah amino - karboksil, membentuk lembar β paralel; o Mereka dapat ditempatkan di arah yang berlawanan, kemudian membentuk lembar β antiparalla.
Rantai lateral limbah asam amino yang berdekatan menonjol dari kerangka rantai dalam arah yang berlawanan, sehingga menimbulkan pola bergantian. Beberapa struktur protein membatasi jenis asam amino dari struktur β.
Misalnya, dalam protein yang dikemas padat, asam amino rantai pendek, seperti glisin dan alanin pada permukaan kontaknya lebih sering.
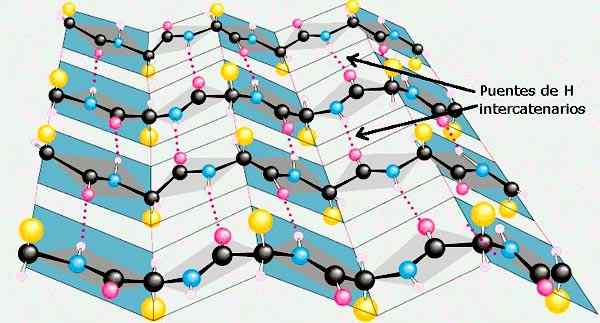 Lembar β dari struktur sekunder protein. Diambil dan diedit dari: Preston Manor School + JFL [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)].
Lembar β dari struktur sekunder protein. Diambil dan diedit dari: Preston Manor School + JFL [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Konformasi lain dari struktur sekunder
Helix 310
Struktur ini ditandai dengan menyajikan 3 limbah asam amino per putaran. Struktur ini telah diamati pada beberapa protein, tetapi tidak terlalu sering terjadi.
Helix π
Struktur ini, sementara itu, memiliki 4,4 limbah asam amino dari putaran spiral dan 16 elemen hidrogen link loop. Meskipun konfigurasi ini dimungkinkan secara sterik, itu tidak pernah diamati di alam.
Dapat melayani Anda: dextrose kentang agar: fondasi, persiapan dan penggunaanPenyebab yang mungkin dari ini bisa menjadi pusat berongga, terlalu besar untuk memungkinkan kinerja gaya van der Waals yang akan membantu menstabilkan struktur, dan namun terlalu kecil untuk memungkinkan lewatnya molekul air.
Struktur superscundaria
Struktur supersundary adalah kombinasi struktur sekunder α dan lembaran lipat β β lembar. Struktur ini dapat terjadi pada banyak protein globular. Ada berbagai kemungkinan kombinasi, yang masing -masing memiliki karakteristik khusus.
Beberapa contoh struktur supersecundarias adalah: satuan βαβ, di mana dua lembaran β paralel dihubungkan oleh segmen baling -baling α; itu satuan αα, ditandai oleh dua αices berturut -turut tetapi dipisahkan oleh segmen non -helikal, terkait dengan kompatibilitas rantai sampingnya.
Beberapa lembar β dapat mundur dengan sendirinya memberikan konfigurasi barel β, sedangkan lembar β antipaallala ditarik kembali apakah itu merupakan struktur supersekundaria yang disebut Kunci Yunani.
Referensi
- C.K. Mathews, k.DAN. Van Hold & K.G. Ahern (2002). Biokimimia. Edisi ke -3. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, hlm. Mayes, d.C. Granner & v.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biokimimia. Edisi ke -5. W. H. Freeman and Company.
- J.Koolman & k.-H. Roehm (2005). Atlas dari warna biokimia. Edisi ke -2. Thieme.
- KE. Lehninger (1978). Biokimia. Edisi omega, s.KE.
- T. McKee & J.R. McKee (2003). Biokimia: Dasar Kehidupan Molekuler. 3Rd Edisi. The McGraw-Hiii Companies, Inc.
- « Guncangan elastis dalam dimensi, kasus khusus, latihan
- Karakteristik nilai saat ini, rumus, dan contoh »

