Rutherford Eksperimen Sejarah, Deskripsi dan Kesimpulan
- 2367
- 83
- Tommie Smith
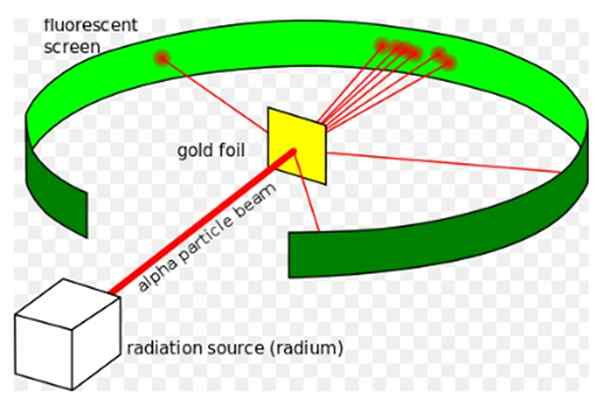
Dia Eksperimen Rutherford, dilakukan antara tahun 1908 dan 1913, itu terdiri dari membombardir lembaran emas tipis 0.0004 mm tebal, dengan partikel alfa dan menganalisis pola dispersi yang ditinggalkan oleh partikel -partikel ini pada layar fluoresen.
Sebenarnya, Rutherford melakukan banyak eksperimen, menyempurnakan detailnya. Setelah menganalisis hasilnya dengan cermat, dua kesimpulan yang sangat penting terungkap:
-Beban positif atom terkonsentrasi di suatu daerah yang disebut inti.
-Inti atom ini sangat kecil dibandingkan dengan ukuran atom.
 Gambar 1. Eksperimen Rutherford. Sumber: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Gambar 1. Eksperimen Rutherford. Sumber: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Ernest Rutherford (1871-1937) adalah seorang fisikawan yang lahir di Selandia Baru, yang bidangnya adalah radioaktivitas dan sifat materi. Radioaktivitas adalah fenomena baru -baru ini ketika Rutherford memulai eksperimennya, telah ditemukan oleh Henri Becquerel pada tahun 1896.
Pada tahun 1907 Rutherford pindah ke Universitas Manchester di Inggris untuk mempelajari struktur atom, menggunakan partikel alfa ini sebagai probe untuk meneliti interior struktur kecil seperti itu. Fisikawan Hans Geiger dan Ernest Marsden menemaninya dalam tugas itu.
Mereka memiliki harapan melihat bagaimana partikel alfa, yang merupakan atom helium terionisasi ganda, berinteraksi dengan atom emas yang unik, untuk memastikan bahwa setiap penyimpangan yang dialami hanya karena gaya listrik.
Namun, sebagian besar partikel alfa melintasi lembaran emas hanya menderita deviasi kecil.
Fakta ini sesuai dengan model atom Thomson, namun, mengejutkan para peneliti, sebagian kecil partikel alfa mengalami penyimpangan yang cukup luar biasa.

Dan persentase partikel yang lebih kecil kembali, memantul sepenuhnya ke belakang. Mengapa hasil yang tidak terduga ini?
[TOC]
Deskripsi dan kesimpulan dari percobaan
Faktanya, partikel alfa yang digunakan Rutherford sebagai probe, adalah inti helium, dan pada saat itu hanya diketahui bahwa partikel -partikel ini memiliki muatan positif. Hari ini diketahui bahwa partikel alfa terdiri dari dua proton dan dua neutron.
Partikel Alfa dan Beta telah diidentifikasi oleh Rutherford sebagai dua jenis radiasi yang berbeda dari uranium. Partikel alfa, jauh lebih masif daripada elektron, memiliki muatan listrik yang positif, sedangkan partikel beta dapat berupa elektron atau positron.
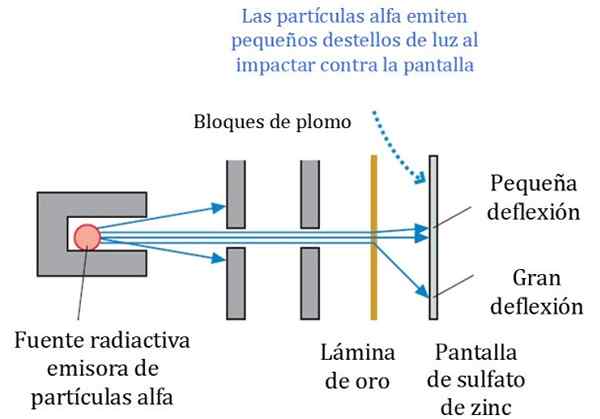 Gambar 2. Skema terperinci dari eksperimen Rutherford, Geiger dan Marsden. Sumber: r. Ksatria. Fisika untuk Ilmuwan dan Teknik: Pendekatan Strategi. Pearson.
Gambar 2. Skema terperinci dari eksperimen Rutherford, Geiger dan Marsden. Sumber: r. Ksatria. Fisika untuk Ilmuwan dan Teknik: Pendekatan Strategi. Pearson. Gambar 2 menunjukkan skema percobaan yang disederhanakan. Balok partikel alfa berasal dari sumber radioaktif. Geiger dan Marsden menggunakan gas radon sebagai emitor.
Blok timbal digunakan untuk mengarahkan radiasi ke lembaran emas dan mencegahnya berhenti langsung ke layar fluoresen. Timbal adalah bahan yang menyerap radiasi.
Dapat melayani Anda: Centrioles: Fungsi dan KarakteristikKemudian balok yang diarahkan, dipengaruhi pada lembaran emas tipis dan sebagian besar partikel mengikuti jalan mereka ke layar seng sulfat, di mana mereka meninggalkan jejak ringan kecil. Geiger bertugas menghitung satu per satu, meskipun mereka kemudian merancang perangkat yang melakukannya.
Fakta bahwa beberapa partikel mengalami defleksi kecil tidak mengejutkan Rutherford, Geiger dan Marsden. Lagi pula, dalam atom ada muatan positif dan negatif yang memberikan kekuatan pada partikel alfa, tetapi karena atomnya netral, yang sudah mereka ketahui, penyimpangan harus kecil.
Kejutan percobaan adalah bahwa beberapa partikel positif terpental hampir secara langsung.
Kesimpulan
Sekitar 1 dari 8000 partikel alfa mengalami defleksi pada sudut yang lebih besar dari 90º. Sedikit, tetapi cukup untuk mempertanyakan beberapa hal.
Model atom di Boga adalah dari Thomson's Pudin, mantan profesor Rutherford di Laboratorium Cavendish, tetapi dia bertanya -tanya apakah gagasan atom tanpa inti dan dengan elektron yang tertanam sebagai kismis, itu benar.
Karena ternyata defleksi besar partikel alfa ini dan fakta bahwa beberapa dapat kembali, itu hanya dapat dijelaskan jika atom memiliki inti yang kecil, berat dan positif. Rutherford berasumsi bahwa hanya kekuatan daya tarik dan tolakan listrik, seperti yang ditunjukkan oleh hukum Coulomb, bertanggung jawab atas penyimpangan apa pun.
Ketika beberapa partikel alfa secara langsung mendekati nukleus dan karena gaya listrik bervariasi dengan kuadrat terbalik dari jarak, mereka merasakan tolakan yang menyebabkan mereka dispersi sudut besar atau penyimpangan ke belakang.
Untuk memastikan, Geiger dan Marsden mengalami lembaran pemboman logam yang berbeda, tidak hanya emas, meskipun logam ini adalah yang paling tepat untuk kelenturan mereka, untuk membuat lembaran yang sangat halus.
Saat memperoleh hasil yang serupa, Rutherford yakin bahwa beban positif dalam atom harus ditempatkan di nukleus, dan tidak tersebar di seluruh volume, seperti yang dipentingkan Thomson dalam modelnya.
Di sisi lain, seperti sebagian besar partikel alfa, itu terjadi tanpa menyimpang, intinya harus sangat, sangat kecil dibandingkan dengan ukuran atom. Namun, inti ini harus memusatkan sebagian besar massa atom.
Pengaruh dalam model atom
Hasilnya sangat terkejut pada Rutherford, yang menyatakan di sebuah konferensi di Cambridge: “… Ini seperti saat Anda menembakkan peluru meriam 15 inci ke selembar kertas sutra dan proyektil memantul langsung kepada Anda dan memukul Anda".
Dapat melayani Anda: 10 fungsi kerangka teori investigasiKarena hasil ini tidak dapat dijelaskan oleh model atom Thomson, Rutherford mengusulkan bahwa atom dibentuk oleh nukleus, sangat kecil, sangat masif dan dimuat secara positif. Elektron tetap menggambarkan orbit di sekitarnya, sistem miniatur surya yang.
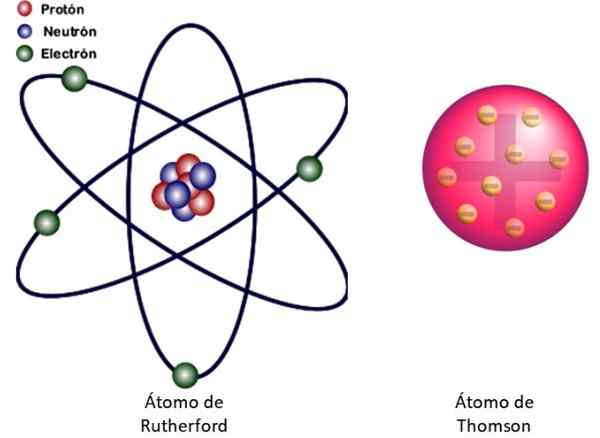 Gambar 3. Di sebelah kiri model atom Rutherford dan di sebelah kanan model tipe Buddin dari Thomson. Sumber: Wikimedia Commons. Gambar Kiri: JCYMC90 [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Gambar 3. Di sebelah kiri model atom Rutherford dan di sebelah kanan model tipe Buddin dari Thomson. Sumber: Wikimedia Commons. Gambar Kiri: JCYMC90 [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Ini adalah model nuklir atom yang ditunjukkan pada Gambar 3 di sebelah kiri. Karena elektron juga sangat, sangat kecil, ternyata atom hampir semuanya .. . kosong! Oleh karena itu, sebagian besar partikel alfa melintasi lembaran tanpa menyimpang.
Dan analogi dengan tata surya miniatur sangat sukses. Inti atom memainkan peran matahari, yang mengandung hampir seluruh massa ditambah beban positif. Elektron mengorbit di sekitar mereka seperti planet dan membawa beban negatif. Set netral secara elektrik.
Tentang distribusi elektron dalam atom, percobaan Rutherford tidak menunjukkan apa -apa. Dapat dianggap bahwa partikel alfa akan memiliki beberapa interaksi dengan mereka, tetapi massa elektron terlalu kecil dan tidak mampu secara signifikan mengalihkan partikel.
Kekurangan dalam model Rutherford
Masalah dengan model atom ini justru perilaku elektron.
Jika ini tidak statis, tetapi mengorbit nukleus atom dalam orbit melingkar atau elips, diarahkan oleh tarik listrik, mereka akan berakhir terburu -buru ke nukleus.
Ini karena elektron yang dipercepat kehilangan energi, dan jika itu terjadi, itu akan menjadi runtuhnya atom dan materi.
Untungnya ini bukan yang terjadi. Ada semacam stabilitas dinamis yang menghindari keruntuhan. Model atom berikutnya, setelah Rutherford's, adalah dari Bohr, yang memberikan beberapa jawaban mengapa keruntuhan atom tidak terjadi.
Proton dan neutron
Rutherford terus melakukan eksperimen dispersi. Antara 1917 dan 1918, ia dan asistennya William Kay memilih untuk mengebom.
Terkejut lagi, saat mendeteksi inti hidrogen. Ini adalah persamaan reaksi, transmutasi nuklir buatan pertama tidak pernah dicapai:
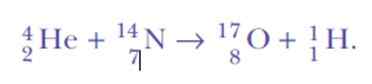 Nah, jika partikel alfa adalah inti helium, dari mana inti hidrogen berasal?
Nah, jika partikel alfa adalah inti helium, dari mana inti hidrogen berasal?
Jawabannya adalah: dari nitrogen yang sama. Rutherford telah ditugaskan ke hidrogen atom nomor 1, karena menjadi elemen paling sederhana dari semua: inti positif dan elektron negatif.
Rutherford telah menemukan partikel mendasar yang disebutnya proton, nama yang berasal dari kata Yunani Pertama. Dengan cara ini, proton adalah konstituen penting dari setiap nukleus atom.
Dapat melayani Anda: volumeKemudian, pada tahun 1920, Rutherford mengusulkan bahwa harus ada partikel netral dan dengan massa yang sangat mirip dengan proton. Dia menyebut partikel ini neutron dan merupakan bagian dari hampir semua atom yang diketahui. Fisikawan James Chadwick akhirnya mengidentifikasinya pada tahun 1932.
Bagaimana model skala atom hidrogen?
Atom hidrogen, seperti yang telah kita katakan, yang paling sederhana dari semuanya. Namun, tidak mudah untuk menguraikan model untuk atom ini.
Penemuan berturut -turut memunculkan fisika kuantum dan seluruh teori yang menggambarkan fenomena tingkat atom. Selama proses ini, model atom juga berkembang. Tapi mari kita lihat pertanyaan sedikit:
Atom hidrogen memiliki nukleus yang terdiri dari proton (positif) dan memiliki elektron tunggal (negatif).
Jari -jari atom hidrogen telah diperkirakan 2.1 x 10-10 m, sedangkan protonnya 0.85 x 10 -limabelas m atau 0.85 femtometer. Nama unit kecil ini adalah karena Enrico Fermi dan banyak digunakan saat mengerjakan skala ini.
Nah, hasil bagi antara jari -jari atom dan nukleus adalah urutan 105 M, yaitu, atomnya 100.000 kali lebih besar dari nukleus!.
Namun, kita harus ingat bahwa dalam model kontemporer, berdasarkan mekanika kuantum, elektron melibatkan nukleus dalam semacam awan yang disebut orbital (Orbital bukan orbit) dan elektron, pada skala atom, tidak tepat waktu.
Jika atom hidrogen secara luas melebar - dengan ukuran lapangan sepak bola, maka nukleus yang terdiri dari proton positif akan menjadi ukuran semut di tengah lapangan, sedangkan elektron negatif akan seperti jenis hantu, tersebar di seluruh lapangan dan mengelilingi nukleus positif.
Model atom hari ini
Model atom "planet" ini sangat root dan merupakan gambar yang dimiliki kebanyakan orang dari atom, karena sangat mudah untuk divisualisasikan. Namun, ini bukan Model diterima hari ini di bidang ilmiah.
Model atom kontemporer didasarkan pada mekanika kuantum. Dia menunjukkan bahwa elektron dalam atom bukanlah titik kecil dengan beban negatif yang mengikuti orbit yang tepat, seperti yang dibayangkan oleh Rutherford.
Sebaliknya, elektronnya berserakan Di daerah, di sekitar nukleus positif, disebut Orbital Atom. Darinya kita bisa tahu kemungkinan untuk bertemu di satu negara bagian atau lainnya.
Meskipun demikian, model Rutherford berarti kemajuan besar dalam pengetahuan tentang struktur bagian dalam atom. Dan mereka menggerebek jalan bagi lebih banyak peneliti untuk terus menyempurnakannya.
Referensi
- Andriessen, m. 2001. Kursus HSC. Fisika 2. Jacaranda HSC Science.
- Arfken, g. 1984. Fisika Universitas. Pers Akademik.
- Knight, r. 2017. Fisika untuk Ilmuwan dan Teknik: Pendekatan Strategi. Pearson.
- Fisika OpenLab. Eksperimen Rutherford-Geiger-Marsden. Dipulihkan dari: Fisika Copenlab.org.
- Rex, a. 2011. Dasar -dasar fisika. Pearson.
- Tyson, t. 2013. Eksperimen Hamburan Rutherford. Pulih dari: 122.Fisika.Ucdavis.Edu.
- Xaktly. Eksperimen Rutherford. Pulih dari: xaktly.com.
- Wikipedia. Eksperimen Rutherford. Pulih dari: itu.Wikipedia.org.
- « Karakteristik nutrisi autotrof, tahapan, jenis, contoh
- Anna Freud Biografi, Teori, Mekanisme Pertahanan, Bekerja »

