Karakteristik dan contoh reaksi yang ireversibel
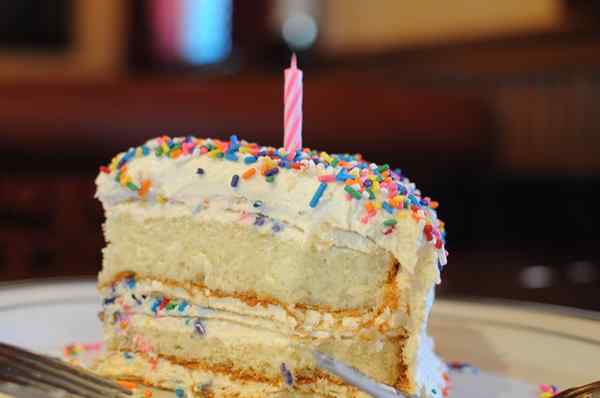
- 1823
- 180
- Miss Wm Hudson
A Reaksi yang tidak dapat diubah Ini adalah salah satu yang hampir tidak mencapai keadaan keseimbangan dan, oleh karena itu, semua reagen telah menjadi produk. Dikatakan bahwa hal itu terjadi dalam satu arah: dari kiri ke kanan, karena produk tidak dapat direbut kembali untuk berasal reagen lagi.
Saat ini ada beberapa teori dan sudut dari mana ireversibilitas reaksi kimia dapat dijelaskan. Visi paling sederhana adalah dengan mempertimbangkan seberapa tidak stabil reagen, stabilitas produk, atau jika gas atau padatan terbentuk yang keluar atau terpisah dari media reaksi.

Reaksi ireversibel sangat umum setiap hari ke hari. Jika kita melihat perubahan di lingkungan kita untuk membalikkan efeknya, perlu waktu mundur, maka itu pasti akan menjadi jenis reaksi kimia ini. Misalnya, kue saja tidak akan kembali ke keadaan awalnya: bahan -bahannya.
Namun, produk dari reaksi yang tidak dapat diubah dapat menderita reaksi yang menjadikannya reagen. Ini adalah kasus herrbles, yang diobati dengan agen pereduksi yang kuat dapat memulihkan besi logam yang terkandung di dalamnya.
[TOC]
Karakteristik reaksi ireversibel
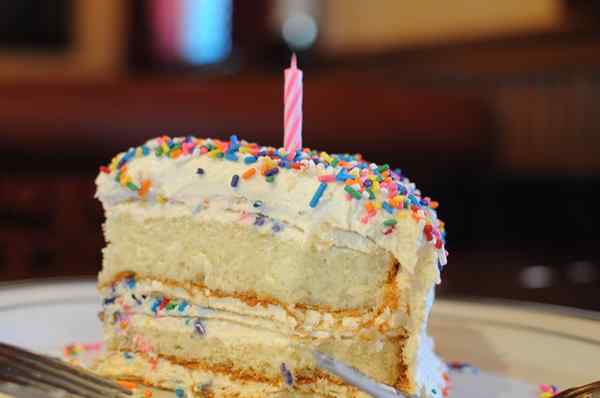 Persiapan kue atau kue terdiri dari sejumlah besar reaksi ireversibel yang berkembang secara bersamaan. Sumber: Pxhere.
Persiapan kue atau kue terdiri dari sejumlah besar reaksi ireversibel yang berkembang secara bersamaan. Sumber: Pxhere. Persamaan Kimia Umum
Reaksi yang tidak dapat diubah dapat diwakili oleh persamaan kimia sederhana, dengan asumsi bahwa dua spesies reaktif berpartisipasi, A dan B:
A + b => c + d
Reaksi A dan B ireversibel untuk berubah menjadi c dan d. Tidak ada tempat untuk keseimbangan yang akan ditetapkan. Apa yang bereaksi tidak beregenerasi, dan apa yang tidak, akan tetap kelebihan karena kinerja reaksi itu sendiri, atau karena salah satu reagen telah dikonsumsi.
Dapat melayani Anda: orcein: fondasi dan persiapanPerhatikan bahwa mereka tidak ditentukan di mana keadaan agregasi masing -masing reagen atau produk berada (padat, gas atau cairan).
Ada reaksi di mana jumlah c dan d tercela, karena sifat kimianya, bumbu untuk beregenerasi dan b. Jika ini terjadi secara seimbang, dikatakan bahwa itu sangat terlantar ke kanan; yaitu, menuju pembentukan produk.
Hanya dalam kasus -kasus ini tidak ada keamanan untuk menyatakan bahwa reaksi yang diduga tidak diragukan lagi tidak dapat diubah. Namun, situasi seperti itu biasanya tidak terjadi secara teratur dalam reaksi yang menunjukkan perubahan yang terlalu penting.
Perubahan Kimia
Ini bukan aturan umum atau definitif, tetapi beberapa reaksi yang tidak dapat diubah menghasilkan perubahan kimia yang luar biasa. Misalnya, reaksi yang sangat eksotermik dipertimbangkan dalam esensi yang tidak dapat diubah, karena jumlah energi dalam bentuk panas dan cahaya yang dilepaskan.
Alasan yang sama berlaku ketika kita mengamati penampilan gas, baik menggelegak dada cairan, atau mengalir pori -pori padatan. Jika gas ini lolos dari media reaksi, tidak mungkin untuk berpartisipasi dalam pembentukan keseimbangan; Artinya, tidak akan bereaksi untuk meregenerasi reagen apa pun.
Demikian juga, pembentukan padatan atau endapan menyiratkan dalam tindakan bahwa reaksi tidak dapat diubah, karena hanya permukaannya yang masih akan memiliki kontak dengan media reaksi. Dan jika padatan ini memiliki struktur yang sangat stabil, apalagi akan berpartisipasi dalam keseimbangan (selain kelarutannya), karena partikelnya akan dikurung.
Di sisi lain, Anda tidak selalu bisa mempercayai perubahan warna. Banyak reaksi di mana ini sebenarnya dihargai, dan cepat atau lambat perubahannya terbalik.
Dapat melayani Anda: lithium bromide: struktur, sifat, penggunaan, risikoProduk stabil dan reagen yang tidak stabil
Karakteristik reaksi ireversibel yang lebih umum adalah bahwa produk yang terbentuk jauh lebih stabil daripada reagen yang berpartisipasi reaksi. Ini menjelaskan mengapa C dan D tidak lagi "ingin" bergabung kembali ke regenerasi dan B, karena yang terakhir adalah spesies yang lebih tidak stabil.
Stabilitas ini dapat diprediksi dengan mengetahui struktur produk, seberapa kuat dan stabil ikatan baru, atau bahkan, melalui mekanisme molekuler yang menunjukkan langkah -langkah reaksi berturut -turut.
Reversibilitas yang jelas
Ada reaksi ireversibel yang secara praktis akan membutuhkan waktu untuk dikembalikan sehingga reagen akan terbentuk lagi. Atau lebih dari reaksi, mereka akan menjadi perubahan atau proses yang melibatkan serangkaian mereka. Ini karena ini bukan tentang membalikkan reaksi, tetapi banyak dan secara instan. Misalnya: dekomposisi buah -buahan.
Reaksi ireversibel lainnya sebaliknya, dapat dibalik jika produk mereka bereaksi dengan spesies lain. Ada juga reaksi yang terjadi dalam "versi terbalik" melalui berbagai proses atau mekanisme. Contoh yang paling terkenal adalah respirasi seluler dan fotosintesis, membedakan bahwa yang terakhir memanfaatkan energi matahari.
Contoh
Beberapa contoh representatif dari reaksi ireversibel akan disebutkan di bawah ini.
Oksidasi
Materi saat teroksidasi melakukannya dengan tidak dapat diubah kecuali jika bersentuhan dengan agen pereduksi. Logam ketika teroksidasi muncul di permukaannya lapisan oksida, yang diendapkan dengan kelembaban dan karbon dioksida, selain garam, proses korosi dimulai.
Oksida logam tidak akan disinter.
Pembakaran
Semua bahan organik yang bereaksi dengan oksigen kuat, akan menderita pembakaran dan akan melepaskan dari gas dan abu oksida. Oksida ini, pada dasarnya co2, H2ATAU TIDAK2 Dan sebagainya2, Mereka tidak akan pernah bergabung kembali untuk menimbulkan molekul awal. Ini adalah kasus plastik, hidrokarbon, kayu, bahan tumbuhan dan hewan.
Itu bisa melayani Anda: metil salisilatNetralisasi asam berbasis kuat
Saat asam dan basa kuat bereaksi atau menetralkan, spesies yang dihasilkan tidak pulih lagi untuk menghasilkannya. Misalnya, NaOH dan HCl bereaksi untuk menghasilkan NaCl dan H2Atau, keduanya spesies yang sangat stabil:
NaOH + HCl => NaCl + H2SALAH SATU
Reaksi ini tidak dapat diubah, tidak ada titik di mana telah diverifikasi bahwa bagian dari NaOH atau HCl telah regenerasi. Hal yang sama berlaku untuk sepasang asam lainnya dan basa yang kuat.
Pembubaran Logam
Logam saat melarutkan asam kuat garam, air dan gas terbentuk. Misalnya, tembaga diserang oleh asam nitrat untuk memberikan tembaga, air dan nitrogen dioksida:
Cu + 4Hno3 => Cu (tidak3)2 + 2h2O + 2no2
Solusi yang dihasilkan memiliki warna kebiruan, dan pernah dengan sihir akan muncul kembali partikel tembaga, menunjukkan pembentukan tembaga logam.
Saponifikasi
Akhirnya, kami memiliki reaksi saponifikasi, yang tidak dapat diubah; Meskipun beberapa langkah internalnya dapat dibalikkan. Sabun yang berasal tidak akan menjadi lemak tempat mereka melanjutkan; Bahkan kalium hidroksida, koh, basis yang kuat, tidak dapat diregenerasi dengan tindakan keseimbangan apa pun.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- BBC. (2020). Apa yang tidak dapat diubah? Diperoleh dari: BBC.bersama.Inggris
- Akademi Khan. (2020). Reaksi kimia. Pulih dari: Khanacademy.org
- Fakta Monster. (2020). Ilmu DK: Reaksi Kimia. Pulih dari: factmonster.com
- Ginesa Blanco. (16 Oktober 2019). Benarkah tidak ada reaksi kimia yang tidak dapat diubah? Negara. Pulih dari: elpais.com
- « Karakteristik dan contoh reaksi reversibel
- Formula Minimum Cara Menghapus Formula Minimum, Contoh dan Latihan »

