Sejarah Fosfor, Sifat, Struktur, Perolehan, Penggunaan

- 1987
- 254
- Jessie Harvey
Dia cocok Ini adalah elemen non -metalik yang diwakili oleh simbol kimia P dan memiliki nomor atom 15. Ini menyajikan tiga bentuk alotropik utama: fosfor putih, merah dan hitam. Fosfor putih phosphorescent, terbakar secara spontan saat terpapar udara dan juga sangat beracun.
Fosfor putih pada suhu 250 ° C menjadi fosfor merah; bentuk polimer, tidak larut dan itu tidak terbakar di udara. Pada suhu dan tekanan tinggi, serta di hadapan atau tidak dari katalis, fosfor hitam diperoleh, yang menyerupai grafit dan merupakan konduktor listrik yang baik.
 Fosfor putih disimpan dalam botol dengan air. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Fosfor putih disimpan dalam botol dengan air. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Fosfor diisolasi untuk pertama kalinya oleh h. Merek, pada 1669. Untuk melakukan ini, urin digunakan sebagai sumber elemen ini. Pada 1770, w. Scheele menemukan bahwa dia juga bisa mengisolasi fosfor tulang.
Selanjutnya, karena penciptaan oven listrik oleh j. Burgess Readman (1800), batuan fosfat menjadi sumber utama produksi fosfor dari bijih fluoroapatite, hadir di dalamnya.
Fosfor adalah dua belas elemen yang lebih berlimpah dari kerak bumi, dan mewakili 0,1% dari beratnya. Selain itu, ini adalah elemen keenam dalam kelimpahan dalam tubuh manusia; Terutama terkonsentrasi dalam tulang dalam bentuk hidroksilapatit.
Oleh karena itu merupakan elemen penting untuk makhluk hidup, menjadi salah satu dari tiga nutrisi utama tanaman. Fosfor adalah bagian dari struktur kimia asam nukleat; senyawa penyimpanan energi (ATP), koenzim; dan secara umum, senyawa metabolisme.
[TOC]
Sejarah
- Penemuan
Dalam urin
 Joseph Wright dari Lukisan Derby di mana penemuan fosfor diilustrasikan. Sumber: Joseph Wright dari Derby [domain publik]
Joseph Wright dari Lukisan Derby di mana penemuan fosfor diilustrasikan. Sumber: Joseph Wright dari Derby [domain publik] Fosfor diisolasi oleh Henning Brand pada tahun 1669, menjadi manusia pertama yang mengisolasi suatu elemen. Merek adalah seorang alkemis Jerman dari Hamburg dan berhasil mendapatkan senyawa fosfor dari urin. Untuk melakukan ini, dia mengumpulkan urin 50 ember dan mengizinkannya membusuk.
Merek kemudian menguap urin dan memperoleh residu kehitaman, yang dipertahankan selama beberapa bulan. Untuk ini menambahkan pasir dan menghangatkannya, mengelola untuk menghilangkan gas dan minyak. Akhirnya, ia memperoleh padatan putih yang bersinar dalam gelap dengan warna hijau, yang ia sebut "api dingin".
Istilah 'fosfor', secara kebetulan berasal dari kata Yunani "fosfor" yang berarti pembawa cahaya.
Merek tidak menerbitkan hasil eksperimennya dan menjualnya kepada beberapa alkemis, termasuk: Johann Kraft, Kunckel Lowenstern dan Wilhelm Leibniz. Mungkin, beberapa dari mereka melaporkan karya merek ke Akademi Ilmu Pengetahuan Paris, sehingga menyebarkan investigasi mereka.
Namun, merek tidak benar -benar mengisolasi fosfor, tetapi natrium fosfat amoniak [NH (NH4) PO4]. Pada tahun 1680, Robert Boyle meningkatkan prosedur merek, yang melaluinya ia bisa memperoleh bentuk fosfor yang alotropik (p4).
Di tulang
Johan Gottlieb Gahn dan Carl Wihelm Scheele didirikan pada 1769 bahwa senyawa fosfor, kalsium fosfat, berada di dalam tulang. Tulang -tulang yang tidak disukai menjadi sasaran proses pencernaan dengan asam yang kuat, seperti asam sulfat.
Kemudian produk pencernaan dipanaskan dalam wadah baja dengan batubara dan batubara, sehingga mendapatkan fosfor putih dengan distilasi dalam retort. Tulang -tulang adalah sumber utama yang mendapatkan fosfor sampai tahun 1840, ketika mereka diganti untuk tujuan ini oleh guano.
Di guano
Guano adalah campuran burung burung dan produk dekomposisi dari mereka. Itu digunakan sebagai sumber fosfor dan pupuk di abad ke -19.
- Pengembangan industri
Batuan fosfat menjadi digunakan pada tahun 1850 sebagai sumber fosfor. Ini, bersama -sama dengan penemuan oven listrik untuk menghitung batu oleh James Burges Readman (1888), menjadikan batu -batu fosfat sebagai bahan baku utama produksi dan pupuk fosfor dan pupuk.
Pada tahun 1819, pabrik Cerrillas didirikan, memulai pengembangan industri fosfor.
Sifat fisik dan kimia
Penampilan
Tergantung pada bentuk alotropik, itu bisa berwarna putih, putih tertutup, kuning, merah, merah, ungu atau hitam.
Berat atom
30.973 u
Nomor Atom (Z)
limabelas
Titik lebur
Fosfor putih: 44.15 ºC
Fosfor Merah: ~ 590 ºC
Titik didih
Fosfor putih: 280,5 ºC
Kepadatan (suhu sekitar)
Putih: 1.823 g/cm3
Merah: 2.2-2,34 g/cm3
Violet: 2.36 g/cm3
Hitam: 2,69 g/cm3
Panas fusi
Fosfor putih: 0,66 kJ/mol
Panas penguapan
Fosfor putih: 51,9 kJ/mol
Kapasitas kalori molar
Fosfor putih: 23.824 J/(mol.K)
Keadaan oksidasi
-3, -2, -1, +1, +2, +3, +4 dan +5
Tergantung pada elektronegativitas elemen yang dengannya fosfor dapat menunjukkan keadaan oksidasi +3 atau -3. Fosfor, tidak seperti nitrogen, cenderung bereaksi lebih disukai dengan keadaan oksidasi +5; Begitulah kasus fosfor pentoksida (p2SALAH SATU5 atau p25+SALAH SATU52+).
Dapat melayani Anda: bahan terlarutElektronegativitas
2,19 pada skala Pauling
Energi ionisasi
-Pertama: 1.101 kJ/mol
-Kedua: 2.190,7 kJ/mol
-Ketiga: 2.914 kJ/mol
Konduktivitas termal
Fosfor putih: 0,236 w/(m · k)
Fosfor hitam: 12.1 w/(m · k)
Ini menunjukkan bagaimana fosfor hitam melakukan hampir enam kali lebih panas daripada fosfor putih.
Urutan magnetik
Match putih, merah, ungu dan hitam bersifat diamagnetik.
Isotop
Fosfor memiliki 20 isotop, menjadi yang utama: 31P, satu -satunya isotop stabil dengan kelimpahan 100%; 32P, emitor β isotop- dan dengan setengah kehidupan 14,28 hari; Dan 33P, isotop emitor β- Dan dengan setengah kehidupan 25,3 hari.
Pendar
Fosfor putih phosphorescent dan memancarkan cahaya hijau dalam gelap.
Perubahan alotropik
Fosfor putih tidak stabil dan perubahan suhu mendekati 250 ºC ke bentuk polimer yang dikenal sebagai fosfor merah, yang dapat bervariasi oranye hingga ungu ungu. Ini adalah zat amorf, tetapi bisa menjadi kristal; Tidak bersinar dalam gelap atau terbakar di udara.
Fosfor putih pada suhu dan tekanan tinggi, atau di hadapan katalis, diubah menjadi bentuk polimer selain fosfor merah: fosfor hitam. Ini adalah zat kristal hitam, inert, mirip dengan grafit, dan itu memiliki kemampuan untuk menghidupkan listrik.
Kelarutan
Fosfor putih murni tidak larut dalam air, meskipun dapat dilarutkan dalam karbon sulfida. Sementara itu, kecocokan merah dan hitam tidak larut di dalam air dan kurang mudah menguap daripada fosfor putih.
Reaktivitas
Fosfor terbakar secara spontan di udara untuk membentuk p2SALAH SATU5, Dan ini pada gilirannya dapat bereaksi dengan tiga molekul air untuk membentuk ortofosfat atau asam fosfat (h3PO4).
Dengan aksi air panas berasal dari fosfin (pH3) dan fosfor oxacids.
Asam fosfat bekerja pada batuan fosfat yang menyebabkan kaldrogen atau kalsium fosfat superfosfat [CA2PO4)2].
Anda dapat bereaksi dengan halogen untuk membentuk px halides3, mewakili x ke f, cl, br atau i; o haluros dengan formula px5, Menjadi x, cl atau br.
Juga, fosfor bereaksi dengan logam dan metaloid menyebabkan fosfida, dan sulfur membentuk beberapa sulfida. Di sisi lain, ia berikatan dengan oksigen untuk berasal dari ester. Dengan cara yang sama, dikombinasikan dengan karbon untuk membentuk senyawa organik fosfor.
Struktur dan konfigurasi elektronik
- Tautan dan unit tetrahedral
Atom fosfor memiliki konfigurasi elektronik berikut:
[Ne] 3s2 3p3
Oleh karena itu, lima elektron dari Valencia, seperti nitrogen dan elemen lain dari kelompok 15. Karena ini adalah elemen non -metalik, atom -atomnya perlu membentuk ikatan kovalen sampai Octeto de Valencia selesai. Nitrogen mencapainya ketika ditetapkan sebagai molekul datomik n2, Dengan triple link, nopnn.
Hal yang sama berlaku untuk fosfor: Dua atom P -nya dihubungkan dengan ikatan rangkap tiga untuk membentuk molekul P2, Pasangp; Ini adalah alotrop difosfor. Namun, fosfor memiliki massa atom yang lebih besar daripada nitrogen, dan orbital 3p, lebih difus daripada 2p nitrogen, tumpang tindih dengan efisiensi yang lebih kecil; Oleh karena itu, p2 Itu hanya ada dalam keadaan gas.
Sebaliknya, pada suhu kamar, atom P lebih suka mengatur kovalen dengan cara lain: dalam molekul tetrahedral p4:
 Unit molekul P4 dalam kristal fosfor putih. Sumber: Benjah-BMM27 via Wikipedia.
Unit molekul P4 dalam kristal fosfor putih. Sumber: Benjah-BMM27 via Wikipedia. Perhatikan bahwa pada gambar superior semua atom P memiliki tiga tautan sederhana, bukan tautan triple. Dengan demikian, fosfor dalam p4 Lengkapi Octeto de Valencia. Namun, di P4 Ada ketegangan di tautan p-p, karena sudutnya akan pergi ke mata telanjang menjadi 109,5 °.
- Banyak
Fosfor putih
Gambar unit P yang sama4 Dan ketidakstabilannya menjelaskan mengapa fosfor putih adalah alotropik yang paling tidak stabil dari elemen ini.
Unit p4 Mereka diperintahkan di ruang angkasa untuk mendefinisikan kristal BCC (fase α) dalam kondisi normal. Ketika suhu turun ke -77,95 ºC, kaca BCC diubah menjadi HCP (mungkin), lebih padat (fase β). Yaitu unit p4 Mereka diperintahkan dalam dua lapisan alternatif, A dan B, untuk menetapkan urutan ABAB ..
Fosfor Merah
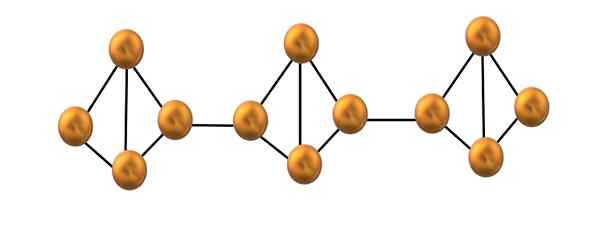 Struktur rantai fosfor merah. Sumber: Gabriel Bolívar.
Struktur rantai fosfor merah. Sumber: Gabriel Bolívar. Pada gambar atas, hanya segmen kecil dari struktur fosfor merah yang ditampilkan. Menjadi tiga unit yang disejajarkan "secara simetris", dapat dikatakan bahwa itu adalah struktur kristal, yang diperoleh dengan memanaskan fosfor ini di atas 250 ºC.
Fosfor merah, bagaimanapun, sebagian besar waktu itu terdiri dari amorf padat, sehingga strukturnya berantakan. Jadi, rantai polimerik dari P4 Mereka akan memiliki pola yang jelas, satu di atas dan yang lainnya di bawah bidang yang sama secara sewenang -wenang.
Perhatikan bahwa ini adalah perbedaan struktural utama antara fosfor putih dan merah: pada yang pertama4 Mereka individu, dan dalam rantai pembentukan kedua. Ini dimungkinkan karena salah satu tautan P-P rusak di dalam tetrahedron untuk dapat terhubung ke tetrahedron tetangga. Dengan demikian, tegangan annular dan fosfor merah mengurangi stabilitas lebih.
Dapat melayani Anda: seng: sejarah, sifat, struktur, risiko, penggunaanKetika ada campuran dari kedua alotrop, itu ditawarkan terlihat sebagai fosfor kuning; Campuran tetrahedra dan rantai fosfor amorf. Faktanya, fosfor putih.
Fosfor Violet atau Hittorf
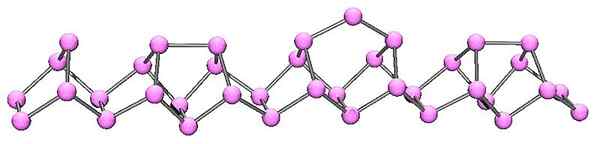 Struktur molekul fosfor violet. Sumber: Kadmium di Bahasa Inggris Wikipedia [Domain Publik]
Struktur molekul fosfor violet. Sumber: Kadmium di Bahasa Inggris Wikipedia [Domain Publik] Fosfor Violet adalah evolusi akhir dari fosfor merah. Seperti dapat dilihat pada gambar superior, itu terus terdiri dari rantai polimer; Tapi sekarang strukturnya lebih rumit. Tampaknya unit struktural bukan lagi p4 tapi p2, diatur sedemikian rupa sehingga mereka membentuk cincin pentagonal yang tidak teratur.
Terlepas dari seberapa asimetris strukturnya, rantai polimer ini berhasil memesan dengan cukup baik dan secara berkala sehingga fosfor violet.
Fosfor Hitam
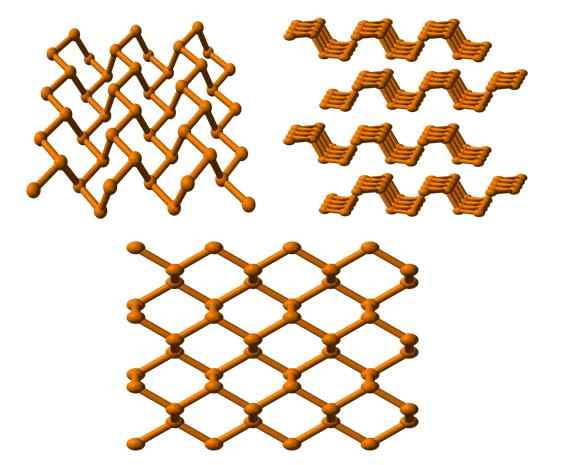 Struktur fosfor hitam terlihat dari beberapa sudut. Sumber: Benjah-BMM27 [Domain Publik].
Struktur fosfor hitam terlihat dari beberapa sudut. Sumber: Benjah-BMM27 [Domain Publik]. Dan akhirnya kita memiliki fosfor paling stabil: warna hitam. Mempersiapkan fosfor putih di bawah tekanan 12.000 atm.
Pada gambar atas (di bawah), dapat dilihat bahwa strukturnya, dari bidang yang lebih tinggi, memiliki kemiripan tertentu dengan grafit; Ini adalah jaringan curam cincin heksagonal (meskipun mereka terlihat persegi).
Di sudut kiri atas gambar, Anda dapat lebih menghargai berkomentar yang baru. Lingkungan molekuler atom P adalah piramida trigonal. Perhatikan bahwa tampilan struktur secara lateral (sudut kanan atas), diatur dalam lapisan yang pas di sisi lain.
Struktur fosfor hitam cukup simetris dan tertib, yang setuju dengan kemampuannya untuk memantapkan dirinya sebagai kristal ortorombik. Penumpukan lapisan polimernya menyebabkan atom P tidak tersedia untuk banyak reaksi kimia; Dan itulah mengapa sangat stabil dan sedikit reaktif.
Meskipun tidak perlu menyebutkannya, kekuatan dispersi London dan massa molar dari padatan fosfat ini adalah yang mengatur beberapa sifat fisiknya; sementara struktur dan ikatannya P-P menentukan sifat kimia dan lainnya.
Dimana itu dan dapatkan
Apatita dan fosfor
Ini adalah elemen dua belas dari kerak bumi dan mewakili 0,1% dari beratnya. Ada sekitar 550 mineral yang mengandung fosfor, Apatita menjadi mineral terpenting untuk mendapatkan fosfor.
Apatita adalah mineral fosfor dan kalsium yang dapat mengandung jumlah variabel fluoride, klorida dan hidroksida, yang formulasinya adalah sebagai berikut: [CA10(PO4)6(F, CL atau OH)2)]. Selain apatit, ada mineral fosfor lain yang memiliki kepentingan komersial; Begitulah kasus Wavelita dan Vivianita.
Fosfat atau batu fosfor adalah sumber fosfor utama. Ini adalah batuan sedimen non-tidak berdetit yang memiliki kandungan fosfor 15-20%. Fosfor biasanya hadir sebagai CA10(PO4)6F2 (Fluoroapatita). Ini juga hadir sebagai hidroksiapatit, meskipun pada tingkat yang lebih rendah.
Selain itu, fluoroapatite dapat ditemukan bagian dari batuan beku dan metamorf, serta batu kapur dan serpih.
Reduksi elektrotermal fluoroapatita
Batuan fosfat terpilih ditransfer ke pabrik pengolahan untuk diproses. Awalnya, mereka dihancurkan untuk mendapatkan fragmen batu yang kemudian ditumbuk di pabrik bola pada 70 revolusi per menit.
Kemudian, produk dari penggilingan fragmen batuan sedang disayangi untuk dapat memecahkannya. Fraksi tersebut dipilih dengan kandungan fosfor 34% seperti fosfor pentoksida (p2SALAH SATU5).
Fosfor putih (p4) Diperoleh secara industri dengan reduksi elektrotermal fluoroapatit dengan karbon pada suhu 1.500 ºC di hadapan silikon oksida:
2ca3(PO4)2(s) + 6sio2(s) + 10 c (s) => p4(g) + casio3(L) + co (g)
P4 Dalam keadaan gas, setelah kondensasi, dikumpulkan dan disimpan sebagai padatan putih yang terendam dalam air untuk mencegah bereaksi dengan udara eksternal.
Paduan
Coppery
Penutup fosfor diproduksi dengan persentase tembaga dan fosfor yang berbeda: Cu 94 % - p 6 %; Cu 92% - p 8%; Cu 85% - p 15%, dll. Paduan ini digunakan sebagai agen deoksidan, pelembab untuk industri tembaga dan juga sebagai nukleant dalam industri aluminium.
Broncine
Mereka adalah paduan tembaga, fosfor dan timah yang mengandung 0,5 - 11% fosfor dan 0,01 - 0,35% timah. Timah meningkatkan resistensi korosi, sedangkan fosfor.
Ini digunakan dalam elaborasi pegas, baut dan, secara umum, dalam artikel yang membutuhkan korosi kelelahan, keausan dan kimia. Penggunaannya dalam baling -baling kapal direkomendasikan.
Dapat melayani Anda: Cadmium (CD): Sejarah, Properti, Struktur, PenggunaanNictelladas
Paduan yang paling terkenal adalah NIPdua puluh, Menggunakan nikel terfosfat dalam paduan pengelasan yang kuat, untuk meningkatkan ketahanannya terhadap erosi kimia, oksidasi dan suhu tinggi.
Paduan ini digunakan dalam komponen mesin gas dan reaksi, galvanoplasti, dan dalam produksi elektroda pengelasan.
Risiko
Fosfor putih menghasilkan luka bakar kulit yang serius dan merupakan racun yang kuat yang bisa menjadi fana dengan dosis 50 mg. Fosfor menghambat oksidasi sel, mengganggu manajemen oksigen seluler, yang dapat menyebabkan degenerasi lemak dan kematian sel.
Keracunan fosfor akut menghasilkan dalam empat hari pertama dari sakit perut, semangat, napas dengan bau bawang putih, muntah yang fosfor, berkeringat, kram otot, dan bahkan keadaan kejutan.
Selanjutnya, penyakit kuning, petechiae, perdarahan, pengaruh miokard dengan aritmia, perubahan sistem saraf pusat dan kematian pada hari kesepuluh asupan dimanifestasikan.
Manifestasi paling jelas dari keracunan fosfor kronis adalah kerusakan pada struktur tulang rahang.
Peningkatan konsentrasi fosfor plasma (hiperfospathia), biasanya disajikan pada pasien dengan gagal ginjal. Ini menyebabkan deposit fosfat yang abnormal dalam jaringan lunak, yang dapat menyebabkan disfungsi pembuluh darah dan penyakit kardiovaskular.
Aplikasi
Fosfor adalah elemen penting untuk tanaman dan hewan. Ini adalah salah satu dari tiga nutrisi utama tanaman, yang diperlukan untuk pertumbuhan dan kebutuhan energinya. Selain itu, ini adalah bagian dari asam nukleat, fosfolipid, produk perantara dari proses metabolisme, dll.
Pada vertebrata fosfor hadir dalam tulang dan gigi dalam bentuk hidroksilapatit.
- Fosfor dasar
 Sekotak korek api atau "fosfor". Sumber: Pxhere.
Sekotak korek api atau "fosfor". Sumber: Pxhere. Dengan fosfor, enamel kimia diproduksi yang digunakan untuk menerangi pemberitahuan yang ditempatkan pada aluminium dan paduannya; serta dalam perunggu tembaga dan terfosforasi.
Ini juga digunakan untuk membuat bom pembakar, granat, pompa asap dan pelacak pelacak. Fosfor merah digunakan dalam elaborasi pertandingan atau kecocokan keselamatan.
Fosfor putih digunakan untuk elaborasi organofosfat. Selain itu, digunakan dalam produksi asam fosfat.
Sejumlah besar fosfor yang diproduksi dibakar untuk produksi fosfor tetraxide (p4SALAH SATU10), diperoleh sebagai bubuk atau padatan.
- Senyawa
Fosfin
Itu adalah bahan baku untuk elaborasi beberapa senyawa fosfor. Itu bertindak sebagai agen doping untuk komponen elektronik.
Asam fosfat
Ini digunakan dalam elaborasi minuman ringan karena rasa khas yang menganugerahkan mereka. Bertindak pada batuan fosfat untuk membentuk kalsium fosfat dihidrogenik2PO4)2], juga dikenal sebagai superfosfat, yang digunakan sebagai pupuk.
Asam fosfat adalah kondisioner elemen dari enamel gigi untuk memfasilitasi adhesi bahan pemulihannya. Ini juga digunakan, dicampur dengan minyak, urea, istirahat, bitumen dan pasir, untuk membentuk aspal; Bahan yang digunakan dalam perbaikan saluran komunikasi tanah.
Organofosfor
Senyawa organofosfor memiliki banyak aplikasi; seperti: retardants api, pestisida, agen ekstraksi, agen aksi saraf dan pengolahan air.
Dihidrat dihidrat kalsium fosfat
Ini digunakan sebagai pupuk, baking powder, aditif makanan hewani dan dalam elaborasi pasta gigi.
Fosfor pentoksida
Ini digunakan dalam analisis kimia sebagai agen dehidrasi dan dalam sintesis organik sebagai agen kondensor. Senyawa ini terutama dialokasikan untuk produksi asam ortofosfat.
Sodium tripolyphosphate
Ini digunakan dalam deterjen dan sebagai pelembut air, yang meningkatkan aksi deterjen dan membantu menghindari korosi pipa.
Fosfat trisodik
Ini digunakan sebagai zat pembersih dan pelembut air.
Sodium fosfat
Dibasic Sodium Phosphate (NA2HPO4) dan natrium fosfat monobasic (nah2PO4) adalah komponen dari sistem penyerap guncangan pH, yang bahkan bertindak pada makhluk hidup; Di antaranya manusia.
Referensi
- Reid Danielle. (2019). Alotrop Fosfor: Bentuk, Penggunaan & Contoh. Belajar. Pulih dari: belajar.com
- Prof. Robert J. Lancashire. (2014). Kuliah 5c. Struktur elemen, lanjutkan p, s dan i. Pulih dari: chem.Uwimona.Edu.Jm
- BYJU. (2019). Fosfor merah. Pulih dari: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, dkk. (2019). Sifat struktural dan optik elektronik fosfor biru multilayer: studi prinsip pertama. Jurnal Nanomaterials, Vol. 2019, ID Artikel 4020762, 8 halaman. doi.org/10.1155/2019/4020762
- Kata. Dough Stewar. (2019). Fakta Elemen Fosfor. Chemicool. Pulih dari: chemicool.com
- Wikipedia. (2019). Fosfor. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (3 Juli 2019). Fakta fosfor (nomor atom 15 atau simbol elemen p). Pulih dari: thinkco.com
- Linus Pauling Institute. (2019). Fosfor. Dipulihkan dari: LPI.Oregonstate.Edu
- Bernardo Fajardo p. & Héctor Lozano V. (S.F.). Pemrosesan batuan fosfat nasional untuk produksi superfosfat. [PDF]. Pulih dari: bdigital.dan i.Edu.bersama
- Para editor Eeritlopaedia Britannica. (16 November 2018). Elemen Kimia Fosfor. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Reade International Corp. (2018). Paduan tembaga fosfor (cangkir). Pulih dari: reade.com
- Afilip KBM. (27 Desember 2018). Paduan Master Nickel Phosphorus (NIP). Azom. Pulih dari: azom.com
- Lentech b.V. (2019). Tabel Periode: Fosfor. Pulih dari: lentech.com
- Abhijit Naik. (21 Februari 2018). Penggunaan fosfor. Pulih dari: sciencestruck.com
- « Penjelasan Tekanan Manometrik, Rumus, Persamaan, Contoh
- Origin Budaya Trincheras, Karakteristik, Agama, Budaya »

