Unit gaya ionik, cara menghitungnya, contoh

- 2426
- 709
- Dewey Runolfsdottir
Itu kekuatan ionik Ini adalah cara mengekspresikan konsentrasi ion dalam suatu larutan. Konsep ini diperkenalkan pada tahun 1922 oleh Lewis dan Randall saat mengerjakan deskripsi koefisien aktivitas kimia.
Ketika konsentrasi ion dalam larutan tinggi, interaksi elektrostatik antara ion yang berlawanan diproduksi; Yaitu, kation dan anion sangat tertarik, yang menghasilkan konsentrasi ionik yang efektif atau nyata kurang dari yang dihitung untuk reaksi kimia tertentu.
 Kekuatan ionik air laut tinggi, sekitar 0.7, karena konsentrasi garam terlarutnya
Kekuatan ionik air laut tinggi, sekitar 0.7, karena konsentrasi garam terlarutnya Untuk alasan ini, konsep aktivitas kimia diperkenalkan sebagai konsentrasi ionik yang efektif dari suatu larutan, aktivitas kimia menjadi produk molaritas larutan dengan koefisien aktivitas kimia.
Koefisien ini memiliki nilai yang dekat dengan unit (1) untuk solusi ionik encer dan untuk solusi ideal yang disebut SO. Ini adalah solusi di mana interaksi antar molekul antara molekul serupa sama dengan yang ada di antara molekul yang berbeda.
Penciptaan konsep kekuatan ionik berkontribusi pada penjelasan penyimpangan dari perilaku ideal, yang diamati dalam solusi ionik nyata.
[TOC]
Unit gaya ionik
Gaya ionik memiliki unit mol/L (molaritas) atau mol/kg air (kebodohan). Yang terakhir direkomendasikan dalam solusi non -ideal, yang ditandai karena volume campuran mereka tidak sepenuhnya aditif.
Ini berarti, misalnya, berikut ini: jika dicampur 0.5 liter cairan A dan 0.5 liter cairan B, volume yang dihasilkan dari campuran ini, tidak harus sama dengan 1 liter, tetapi bisa berbeda.
Gaya ionik diwakili oleh simbol i.
Dapat melayani Anda: butanal: struktur, sifat, penggunaan dan risikoCara menghitung gaya ionik?
Untuk perhitungan gaya ion dari suatu larutan, konsentrasi semua ion yang ada dalam larutan diperhitungkan, serta valensi masing -masing.
Nilai gaya ionik diperoleh dengan menerapkan rumus berikut:
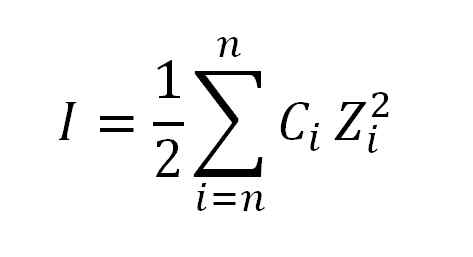 Formula yang digunakan untuk menghitung gaya ionik. Sumber: Gabriel Bolívar.
Formula yang digunakan untuk menghitung gaya ionik. Sumber: Gabriel Bolívar. Di mana saya, seperti yang telah dikatakan, adalah kekuatan ionik; C, sesuai dengan konsentrasi ion ionik atau moral moral; Sedangkan z, mewakili valensi masing -masing (± 1, ± 2, ± 3, dll.).
Ekspresi yang muncul dalam rumus dalam perhitungan gaya ionik (σ) dibaca sebagai ringkasan, yaitu, jumlah produk konsentrasi molar (c) dari masing -masing ion yang ada dalam larutan dengan valencia (z) -nya Kuadrat tinggi.
Seperti yang dapat dilihat, valensi ion memiliki bobot terbesar dalam nilai gaya ionik dari larutan. Misalnya: Valencia (z) dari CA adalah +2, jadi z2 Itu sama 4. Sementara itu, Valencia (Z) dari Na es +1, dan karenanya, z2 Itu sama 1.
Ini menunjukkan bahwa kontribusi ion CA2+ Ke nilai gaya ionik, ke konsentrasi ion molar yang sama, itu empat kali lebih besar dari ion na+.
Pentingnya kekuatan ionik
Gaya ionik adalah ukuran yang memadai dari konsentrasi ionik dari suatu larutan dan merupakan dasar untuk membangun teori Debye-Hückel. Teori ini menggambarkan perilaku ideal solusi ionik.
Gaya ionik berfungsi sebagai dasar untuk menghitung koefisien aktivitas (γyo), parameter yang pada gilirannya memungkinkan perhitungan aktivitas kimia senyawa ionik, aktivitas kimia menjadi konsentrasi efektif dan nyata dari senyawa ionik dalam larutan.
Dapat melayani Anda: aluminium asetat (al (ch3coo) 3): struktur, sifat, penggunaanDengan meningkatkan gaya ion dari suatu larutan, interaksi antara ion meningkat. Oleh karena itu, kurangi γyo dan aktivitas kimia ion.
Peningkatan gaya ionik dapat mengurangi kelarutan protein di lingkungan berair, sifat ini digunakan untuk presipitasi protein yang selektif. Larutan gaya ionik sulfat tinggi digunakan untuk presipitasi dan pemurnian protein plasma.
Contoh kekuatan ionik
Contoh 1
Hitung gaya ionik dari larutan kalium klorida (KCL) 0.3 m.
KCL Disosiasi dengan cara berikut:
Kcl → k+ + Cl-
Kami memiliki dua ion: kation+ (Z =+1) dan cl anion- (Z = -1). Kami kemudian menerapkan rumus untuk menghitung gaya ionik I:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Perhatikan bahwa Valencia -1 dari CL- Itu diambil sebagai 1, nilai absolutnya, karena jika tidak, gaya ionik akan sama dengan 0.
Contoh 2
Hitung gaya ionik dari larutan kalsium sulfat (case4) 0.5m
Kasus4 Itu terpisah sebagai berikut:
Kasus4 → CA2+ + Sw42-
Kami memiliki dua ion: Kation2+ (Z =+2) dan anion42- (Z = -2). Kami kemudian menerapkan rumus untuk menghitung gaya ionik I:
I = 1/2 [c · (+2)2 + C · (-2)2]
= 1/2 [0,5 m · 4 +0.5 m · 4]
= 2 m
Contoh 3
Hitung gaya ionik penyerap guncangan dengan konsentrasi akhir dari natrium fosfat dibasic (NA2HPO4) 0.3 m dan natrium monobasic fosfat (Nah2PO4) 0.4 m.
Na2HPO4 Itu terpisah sebagai berikut:
Dapat melayani Anda: asam arsenat (H3SO4): sifat, risiko dan penggunaanNa2HPO4 → 2nd+ + HPO42-
Sementara nah2PO4 Ini memisahkan diri mengikuti pola berikut:
Nah2PO4 → Na+ + H2PO4-
Kami melanjutkan sebagai latihan sebelumnya, kali ini memiliki anion HPO42- (Z = -2) dan h2PO4- (Z = -1):
I = 1/2 [c · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Perhatikan bahwa konsentrasi Na+ dari na2HPO4 Itu dikalikan dengan 2, karena konsentrasinya ganda. Namun, untuk garam lainnya, nah2PO4, Konsentrasi na+ Ya, kami melipatgandakannya dengan 1, menurut stoikiometri persamaan pembubarannya.
Contoh 4
Hitung gaya ionik larutan natrium klorida (NaCl) 0.15 m dan glukosa (c6H12SALAH SATU6) 0.3 m.
NaCl memisahkan sebagai berikut:
NaCl → NA+ + Cl-
Glukosa, bagaimanapun, tidak dipisahkan pada ion karena hanya memiliki ikatan tipe kovalen dalam struktur kimianya. Oleh karena itu, Valencia de la Glucosa (Z) sama dengan nol (0). Kami kemudian menghitung produk gaya ionik NaCl:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Kekuatan ion. Diperoleh dari: di.Wikipedia.Atau
- Kata. David K. Ryan. (S.F.). Aktivitas & Kekuatan Ionik Kelas 4 Ryan. [PDF]. Diperoleh dari: faculy.UML.Edu
- Universitas Michigan. (S.F.). Pandangan yang lebih rinci tentang keseimbangan kimia. [PDF]. Pulih dari: umich.Edu
- Elsevier b.V. (2020). Kekuatan ion. Ilmiah. Diperoleh dari: Scientedirect.com
- C.D. Kennedy. (1990). Stength ionic dan disosiasi asam. [PDF]. Pulih dari: iubmb.Perpustakaan Online.Wiley.com

