Glut 2 fitur, struktur, fungsi
- 4840
- 1371
- Mr. Darrell Streich
GLUT2 Ini adalah transporter glukosa afinitas rendah yang diekspresikan dalam membran sel pankreas, hati, ginjal dan usus serta astrosit dan Tanicitos. Selain memediasi transportasi glukosa, ia juga terlibat dalam pengangkutan fruktosa, galaktosa dan glukosamin; Jadi lebih dari sekadar konveyor glukosa adalah transporter hexous.
Fakta menghadirkan afinitas rendah untuk glukosa memungkinkan Anda untuk bertindak sebagai protein sensor kadar glukosa darah. Oleh karena itu, berpartisipasi dalam kontrol peraturan dari banyak peristiwa fisiologis yang merespons fluktuasi konsentrasi glukosa darah.
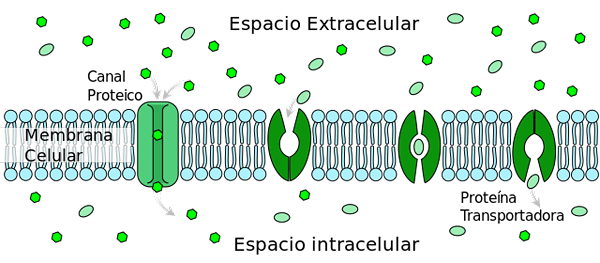
 Transportasi difusi yang difasilitasi dari glukosa tipe 2 (GLUT2) mengubah konformasi yang memobilisasi situs pengikatan glukosa dari sisi luar ke sisi membran internal (protein konveyor). Oleh Ladyofhats [domain publik] (https: // createveCommons.Org/lisensi/by-sa/3.0)], dari Wikimedia Commons.
Transportasi difusi yang difasilitasi dari glukosa tipe 2 (GLUT2) mengubah konformasi yang memobilisasi situs pengikatan glukosa dari sisi luar ke sisi membran internal (protein konveyor). Oleh Ladyofhats [domain publik] (https: // createveCommons.Org/lisensi/by-sa/3.0)], dari Wikimedia Commons. Di antara banyak proses yang mengatur adalah: 1) pelepasan insulin oleh sel pankreas yang distimulasi oleh konsentrasi glukosa tinggi; 2) Sekresi glukagon oleh hepatosit untuk produksi glukosa dalam kasus hipoglikemia.
[TOC]
Transportasi glukosa ke interior sel
Sekitar 75% glukosa yang memasuki sel untuk memberi makan jalur metabolisme produksi energi, melakukannya melalui mekanisme transportasi pasif yang difasilitasi oleh protein membran komprehensif yang disebut transporter.
Mekanisme transportasi ini secara luas dikenal sebagai diseminasi yang diberikan. Itu tidak memerlukan kontribusi energi untuk dilakukan dan diberikan mendukung gradien konsentrasi. Yaitu, dari zona konsentrasi tinggi ke konsentrasi rendah.
Setidaknya 14 isoform transperator difusi memfasilitasi glukosa, termasuk GLUT2, telah diidentifikasi hingga saat ini. Semuanya milik superfamili fasilitator utama (MSF) dan, dengan konsensus, disebut gluts (dengan akronim dalam bahasa Inggris "transporter glukosa").
Itu dapat melayani Anda: myitosis: fase, karakteristik, fungsi, dan organismeBerbeda yang berbeda yang telah ditandai hingga saat ini dikodekan oleh gen SLC2A dan menunjukkan perbedaan yang nyata dalam urutan asam amino, preferensi untuk substrat yang mereka transportasi dan dalam distribusi sel dan jaringan.
Karakteristik GLUT2
GLUT2 memobilisasi glukosa melalui mekanisme transportasi satu arah (uniporta). Fungsi ini juga dilakukan GLUT1, konveyor glukosa paling berlimpah di hampir semua mamalia.
Namun, tidak seperti ini, ia memiliki afinitas yang sangat rendah karena glukosa, yang berarti bahwa ia hanya mampu mengangkutnya ketika konsentrasi gula ini biasanya mencapai nilai yang sangat tinggi dalam medium ekstraseluler.
Meskipun memiliki afinitas rendah terhadap glukosa, ia menghadirkan kapasitas transportasi yang tinggi, yang menyiratkan bahwa ia dapat mengangkut sejumlah besar heksosa ini dengan kecepatan tinggi. Dua karakteristik ini tampaknya terkait dengan peran yang harus ditanggapi oleh transporter ini terhadap perubahan halus dalam konsentrasi glukosa.
Studi karakterisasi molekuler dari transporter ini telah menunjukkan bahwa ini tidak menghadirkan spesifisitas tunggal karena glukosa. Sebaliknya, ia mampu memediasi transportasi pasif fruktosa, galaktosa, tangan dan glikosamin. Menghadirkan afinitas rendah untuk tiga dan afinitas tinggi untuk glukosamin.
Karena semua molekul ini adalah gula dari enam atom karbon, dapat dianggap sebagai transporter heksous daripada transporter glukosa.
Struktur glut2
GLUT2 menghadirkan urutan peptida 55% yang identik dengan transporter afinitas tinggi untuk glukosa GLUT1.
Namun, terlepas dari persentase kesamaan yang rendah antara urutan kedua transporter, penelitian yang dilakukan dengan kristalografi X -ray telah menunjukkan bahwa mereka memiliki struktur yang sama.
Dapat melayani Anda: sitoskeletonStruktur ini sesuai dengan protein transmembraal multipaso dalam α-helix. Artinya, melintasi membran beberapa kali melalui segmen transmembran yang memiliki konfigurasi α-helix.
Seperti pada semua anggota keluarga super fasilitator utama (MSF), yang menjadi miliknya, 12 segmen heliks melintasi membran. Enam di antaranya disusun kembali secara spasial untuk membentuk pori hidrofilik yang melaluinya gula dimobilisasi.
Perlu dicatat bahwa situs serikat heksosa ditentukan oleh orientasi dan pseudopsimetri yang disajikan oleh ujung amino terminal karboksil dan amino dari protein. Keduanya terpapar pada sisi yang sama dari membran menghasilkan rongga di mana pengaturan enam atom gula diakui memfasilitasi persatuan mereka.
Perubahan dalam struktur konveyor terkait dengan mekanisme yang digunakan oleh ini untuk mengangkut gula dari satu sisi membran. Deformasi struktural ini memungkinkan memobilisasi situs serikat ke sisi sitoplasma, di mana pelepasan molekul yang telah diangkut dengan cepat terjadi.
Fungsi GLUT2
Selain memediasi penculikan glukosa, galaktosa dan glukosamin di dalam sel, banyak fungsi fisiologis telah dikaitkan dengan ekspresi transporter ini dalam berbagai jenis seluler.
Banyak dari fungsi -fungsi ini telah ditentukan dengan menggunakan teknik penekanan gen. Yang terakhir terdiri dari mencegah ekspresi gen yang fungsinya diinginkan untuk belajar dalam sel jaringan tertentu atau organisme lengkap.
Dalam hal ini, blokade ekspresi GLUT2 pada tikus telah mengungkapkan bahwa protein ini merupakan cara utama transportasi glukosa di kedua sel ginjal dan hati. Selain pengangkutan galaktosa dan fruktosa tidak terkait dengan generasi glukosa dari gula ini melalui glukoneogenesis.
Dapat melayani Anda: stromatolitSelain itu, telah ditunjukkan bahwa ia memberikan peran regulasi dari berbagai fungsi fisiologis, karena afinitas glukosa rendah memungkinkannya untuk mendeteksi ketika konsentrasi gula ini tinggi.
Kertas glut2 dalam pemeliharaan homeostasis sel
Karena memenuhi fungsi kritis dalam generasi energi oleh semua sel terutama untuk sel saraf, konsentrasi darahnya harus dipertahankan dekat dengan nilai 5mmol/L. Variasi dalam konsentrasi ini selalu dipantau oleh protein pengatur melalui mekanisme "deteksi glukosa".
Mekanisme ini terdiri dari strategi molekuler yang memungkinkan untuk merespons dengan cepat variasi konsentrasi glukosa mendadak. Dalam hal ini, ekspresi GLUT2 dalam membran sel yang fungsinya diaktifkan oleh hiperglikemia memberikan peran peraturan.
Faktanya, telah ditunjukkan bahwa sekresi insulin oleh sel -sel pankreas dipicu oleh deteksi glukosa oleh GLUT2.
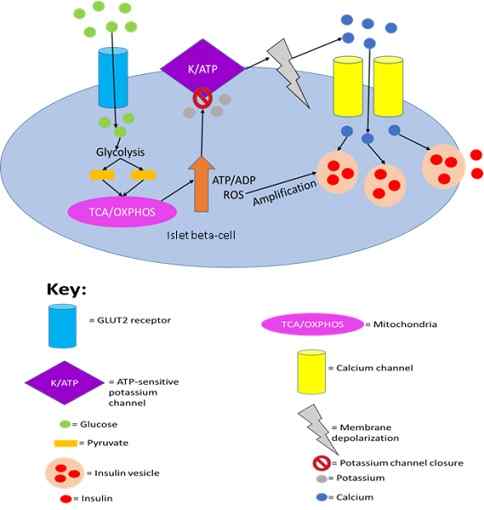
Sekresi insulin oleh sel pankreas ditembakkan oleh deteksi glukosa oleh GLUT2. Oleh Joshua J Reed [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons.
Selain itu, rata -rata kontrol saraf otonom dari makanan, termoregulasi dan pengoperasian sel pankreas yang distimulasi oleh deteksi glukosa.
Ketika kadar GLUT2 menurun dalam sel saraf, mereka menghasilkan sinyal positif untuk memicu sekresi glukagon. Mengingat bahwa glukagon adalah hormon yang mempromosikan produksi glukosa oleh hati dari cadangan glikogen.
Referensi
- Burcelin R, Thorens B. Bukti bahwa sensor glukosa yang bergantung pada ekstrapancreatic controlglcon rahasia. Diabetes. 2001; 50 (6): 1282-1289.
- Kellett GL, Brot-Loche E, Mace OJ, Leturque A. Penyerapan gula di usus: Peran GLUT2. Annu Rev Nutr. 2008; 28: 35-54.
- Lamy CM, Sanno H, Labouèbe G, Picard A, Magnan C, Chatton JY, Thorens B. Neuron GLUT2 yang diaktifkan hipoglikemia dari soliter nukleus traktus menstimulal aktivitas vagal dan rahasia glukagon. Metab sel. 2014; 19 (3): 527-538.
- Mueckler M, Thorens B. Keluarga Transporter Membran SLC2 (GLUT). Aspek Mol Med. 2013; 34 (2-3): 121-38.
- Tarussio D, Metref S, Seyer P, Mounien L, Vallelis D, Magnan C, Foretz M, Thorens B. Sensing glukosa saraf mengatur proliferasi sel β postnatal dan homeostasis glukosa. J Clin Invest. 2014; 124 (1): 413-424.
- B. GLUT2 dalam deteksi glukuko pankreas dan ekstra-pankreas (ulasan). Mol Membi Biol. 2001; 18 (4): 265-273.
- Thorens B, Mueckler M. Transporter glukosa di abad ke -21. Am J Physiol Endocrinol Metab. 2010; 298 (2): E141-E145.
- Thorens b. Glut2, penginderaan glukosa dan homeostasis glukosa. Diabetologi. 2015; 58 (2): 221-232.
- « Karakteristik albaricoque, habitat, sifat, budidaya
- Karakteristik Coyote, Habitat, Makanan, Reproduksi »

