Gugus hidroksil

- 1894
- 100
- Irvin Reichel
Kami menjelaskan apa kelompok hidroksil, karakteristiknya, struktur, dan beberapa contohnya
 Struktur kimia gugus hidroksil
Struktur kimia gugus hidroksil Apa itu kelompok hidroksil?
A Gugus hidroksil Ini adalah kelompok fungsional atau bagian dari kelompok fungsional lain yang ada di banyak senyawa organik dan anorganik. Ini dibentuk oleh atom hidrogen dan salah satu oksigen (karenanya namanya).
Kelompok hidroksil biasanya terkait dengan atom karbon atau elemen non -metalik lainnya seperti sulfur atau fosfor, antara lain, dan merupakan salah satu kelompok fungsional paling penting dalam kimia organik.
Kelompok atom ini hadir dalam kelompok fungsional organik seperti alkohol, fenol dan asam karboksilat, dan merupakan salah satu yang memberikan masing -masing kelompok fungsional sifat kimianya karakteristik karakteristik karakteristik. Dalam struktur yang berbeda dapat direpresentasikan sebagai -oh atau ho-
Karakteristik gugus hidroksil
- Ini terdiri dari atom oksigen dan salah satu hidrogen yang saling terkait dan dihubungkan dengan atom lain dalam molekul melalui ikatan kovalen.
- Hubungan antara atom hidrogen dan oksigen adalah ikatan polar di mana oksigen memiliki beban parsial negatif dan hidrogen beban parsial positif, yang menjadikan gugus hidroksil gugus fungsional polar.
- Ini memiliki struktur yang mirip dengan air. Untuk alasan ini, banyak senyawa yang mengandungnya biasanya larut dalam pelarut tersebut.
- Ini memiliki hidrogen yang terkait langsung dengan atom oksigen, sehingga gugus hidroksil dapat membentuk ikatan hidrogen di mana ia berpartisipasi sebagai kelompok hidrogen donor.
- Memiliki dua elektron bebas pada atom oksigen, gugus hidroksil dapat membentuk dua ikatan hidrogen tambahan yang bertindak sebagai akseptor atom hidrogen.
- Anda dapat bertindak sebagai asam dengan memberikan proton ke basa. Bergantung pada kelompok fungsional yang merupakan bagian dan atom yang terhubung langsung, kelompok hidroksil dapat menunjukkan berbagai tingkat keasaman. Misalnya, dalam alkohol, ia memiliki PKA 15 atau lebih (asam sengit dari air), dalam fenol bervariasi antara 7 dan 10 sedangkan asam karboksilat biasanya antara 4 dan 5.
- Anda juga dapat bertindak sebagai basis Lewis, menyumbangkan salah satu pasangan elektronnya untuk terhubung ke proton lain atau asam Lewis lainnya.
Struktur kelompok hidroksil
Seperti yang disebutkan di antara karakteristik, atom oksigen dan hidrogen dalam gugus hidroksil membentuk ikatan kovalen polar.
Selain itu, atom oksigen membentuk ikatan kovalen kedua dengan atom lain yang merupakan bagian dari molekul sebagai alkohol, fenol ke beberapa senyawa lainnya. Struktur Lewis dari grup ini disajikan di bawah ini:
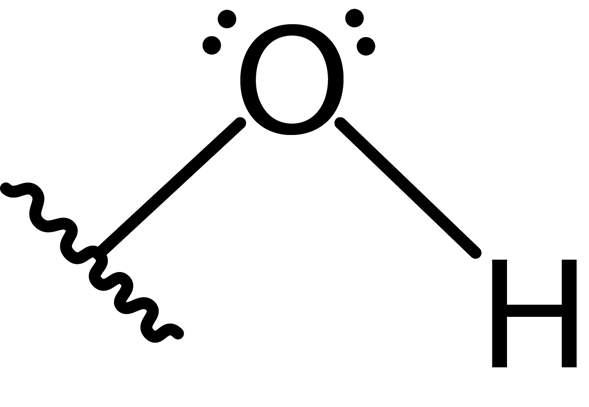
Karena adanya dua pasang elektron bebas pada atom oksigen dan dua ikatan kovalen, gugus hidroksil memiliki geometri sudut dengan sudut sekitar 104 °, sedikit lebih rendah dari sudut tetrahedral. Panjang ikatan oksigen-hidrogen sekitar 0.97 Angstrom.
Gugus hidroksil, anion radikal hidroksil dan hidroksida
Sangat umum untuk membingungkan gugus hidroksil dengan radikal hidroksil dan anion hidroksida, karena semua dibentuk oleh dua atom yang sama, namun, istilah -istilah ini tidak merujuk pada hal yang sama.
Di satu sisi, radikal hidroksil berbeda dari gugus hidroksil di mana ia merupakan radikal bebas dengan sejumlah elektron valensi yang ganjil, dan juga tidak terkait dengan atom atau kelompok atom lainnya (itulah sebabnya diceritakan gratis).
Terlepas dari perbedaan ini, banyak orang secara keliru menggunakan istilah radikal hidroksil untuk merujuk pada gugus hidroksil saat hadir dalam molekul.
Anion hidroksida, di sisi lain, adalah ion dengan beban negatif yang dibentuk oleh hidrogen dan oksigen, sedangkan gugus hidroksil adalah gugus netral.
Selain itu, sementara gugus hidroksil selalu terkait dengan molekul dengan menggunakan ikatan kovalen, senyawa yang mengandung ion hidroksida memiliki ikatan ion antara ini dan beberapa logam seperti natrium, lithium atau kalium.
Dapat melayani Anda: apa anoda dan katoda?Contoh kelompok hidroksil
Alkohol
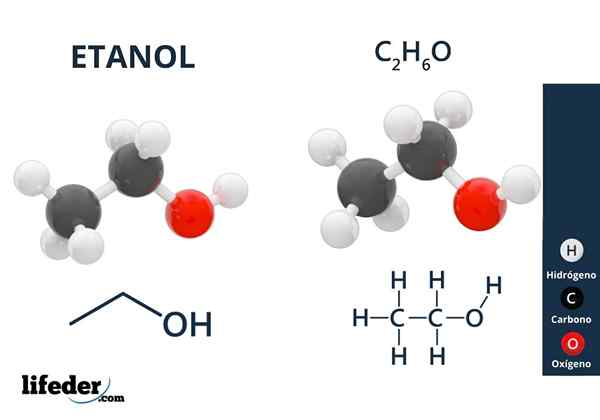 Etanol
Etanol Alkohol memiliki gugus hidroksil terkait dengan karbon alifatik. Contoh alkohol adalah:
- Metil alkohol.
- Etanol.
- Alkohol isopropil.
Fenol
Fenol ditandai dengan memiliki gugus hidroksil yang terkait langsung dengan cincin aromatik. Beberapa contoh fenol umum adalah:
- Fenol.
- Alfa dan Beta-Naftol.
- Ortho, tujuan dan untuk cresol.
Karbohidrat
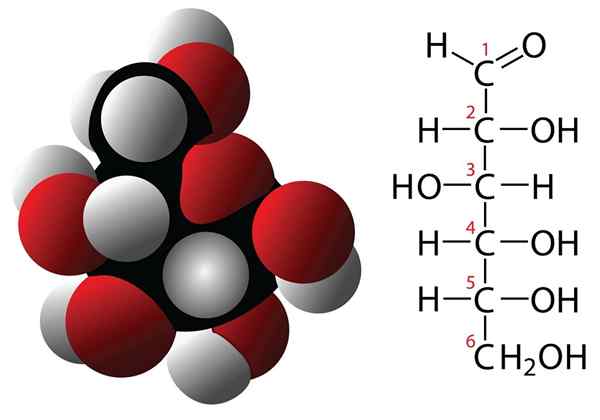 Molekul formula glukosa dan molekul
Molekul formula glukosa dan molekul Karbohidrat adalah senyawa dengan 3 atau lebih atom karbon yang ditandai dengan memiliki formula empiris yang dibentuk oleh karbon dan molekul air. Senyawa -senyawa ini sering memiliki beberapa kelompok hidroksional yang membuatnya sangat larut dalam air. Beberapa contoh karbohidrat adalah:
- Glukosa.
- Fruktosa.
- Sakarosa.
Asam karboksilat
Kelompok fungsional karboksil yang ada dalam asam karboksilat sesuai dengan salah satu gugus fungsi paling asam yang dapat dimiliki molekul organik. Senyawa ini biasanya asam lemah saat membandingkannya dengan beberapa asam mineral, tetapi mereka bisa menjadi sangat asam tergantung pada strukturnya.
Keasaman gugus karboksil disebabkan oleh adanya gugus hidroksil yang terkait dengan gugus karbonil, yang menstabilkan beban negatif dari anion yang terbentuk ketika hidroksil menghasilkan protonnya. Beberapa contoh asam karboksilat adalah:
- Asam asetat.
- Asam benzoat.
- Asam trifluoroasetat.
Asam sulfonat
Asam sulfonat adalah senyawa organik yang dibentuk oleh reaksi antara beberapa senyawa organik dan asam sulfat atau sulfur dioksida. Jenis senyawa ini memiliki gugus hidroksil dan, secara umum, adalah asam yang cukup kuat, sebanding dengan asam sulfat.
Beberapa contoh asam sulfonat adalah:
- Asam pentosulfonat.
- Ortho, sasaran dan isomer asam toluensulfonat.
- Asam Benzeulfonic.
Asam anorganik
Kelompok hidroksil tidak hanya muncul dalam senyawa organik. Banyak senyawa anorganik juga memilikinya, khususnya asam oksakis. Dalam kasus ini, gugus hidroksil secara langsung terkait dengan non -logam, biasanya berbeda dari karbon.
Beberapa contoh asam anorganik yang memiliki gugus hidroksil bersama dengan non -logam yang terkait adalah:
- Asam hipoklor, di mana gugus hidroksil terkait dengan atom klorin.
- Asam sulfat, yang memiliki dua gugus hidroksil yang terkait dengan atom belerang.
- Asam fosfat, di mana tiga gugus hidroksil terkait dengan atom fosfor.

