Struktur, properti, penggunaan, risiko hidroksida merkuri
- 4680
- 1331
- Jessie Harvey
Dia Mercury Hydroxide Ini adalah senyawa anorganik di mana logam merkuri (Hg) memiliki jumlah oksidasi 2+. Formula kimianya adalah HG (OH)2. Namun, spesies ini belum diperoleh dalam bentuk padat dalam kondisi normal.
Merkuri atau merkuri hidroksida hidroksida adalah perantara kehidupan pendek sementara dalam pembentukan hgo merkuri oksida dalam larutan alkali alkali. Untuk penelitian yang dilakukan dalam larutan oksida merkuri HGO, telah disimpulkan bahwa HG (OH)2 Itu adalah basis yang lemah. Spesies lain yang menyertainya adalah hgoh+ dan HG2+.
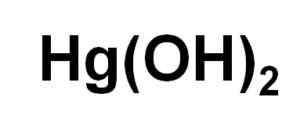 Formula kimia merkuri hidroksida (II). Penulis: Marilú Stea.
Formula kimia merkuri hidroksida (II). Penulis: Marilú Stea. Meskipun tidak dapat diendapkan dalam larutan berair, HG (OH)2 Telah diperoleh dengan reaksi fotokimia merkuri dengan hidrogen dan oksigen pada suhu yang sangat rendah. Itu juga telah diperoleh dalam bentuk copresipitated bersama dengan iman (OH)3, di mana keberadaan ion haluro memberikan pengaruh pada pH di mana copresipitasi terjadi.
Karena tidak mudah diperoleh murni di tingkat laboratorium, belum mungkin untuk menemukan utilitas apa pun untuk senyawa ini, atau menentukan risiko penggunaannya. Namun, dapat disimpulkan bahwa ia menghadirkan risiko yang sama dengan senyawa merkuri lainnya.
[TOC]
Struktur molekul
Struktur merkuri hidroksida (II) Hg (OH)2 Ini didasarkan pada bagian tengah linier yang dibentuk oleh atom merkuri dengan dua atom oksigen ke samping.
Atom hidrogen disatukan dengan struktur pusat ini, masing -masing di sebelah setiap oksigen, yang berbalik dengan bebas di sekitar setiap oksigen. Itu bisa diwakili dengan cara sederhana seperti yang ditunjukkan di bawah ini:
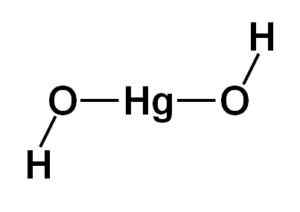 Struktur teoritis merkuri hidroksida (II). Penulis: Marilú Stea
Struktur teoritis merkuri hidroksida (II). Penulis: Marilú Stea Konfigurasi elektronik
Struktur elektronik dari logam merkuri HG adalah sebagai berikut:
[Xe] 5D10 6S2
di mana [xe] adalah konfigurasi elektronik xenon gas mulia.
Saat mengamati struktur elektronik ini, diturunkan bahwa keadaan oksidasi merkuri yang paling stabil adalah yang mana 2 elektron lapisan 6 hilangS.
Dalam HG (OH) Mercuric Hydroxide2, Atom Merkuri (HG) ditemukan dalam keadaan oksidasi 2+. Oleh karena itu, di HG (OH)2 Merkuri memiliki konfigurasi elektronik berikut:
Itu dapat melayani Anda: 30 penggunaan asam karboksilat dalam kehidupan sehari -hari[Xe] 5D10
Tata nama
- Mercury Hydroxide (II)
- Mercuric Hydroxide
- Mercury Dihydroxide
Properti
Berat molekul
236.62 g/mol
Sifat kimia
Menurut informasi yang dikonsultasikan, ada kemungkinan bahwa HG (OH)2 Jadilah senyawa sementara dalam pembentukan HGO dalam medium berair alkali.
Penambahan ion hidroksil (oh-) ke larutan berair dengan ion merkuri Hg2+ Itu mengarah pada presipitasi hgo oxide merkuri padat kuning (II), di mana Hg (OH)2 Itu adalah penumpang atau agen sementara.
 Merkuri oksida (II). Leiem [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikipedia Commons.
Merkuri oksida (II). Leiem [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikipedia Commons. Dalam larutan berair HG (OH)2 Ini adalah perantara hidup yang sangat singkat, karena dengan cepat melepaskan molekul air dan memicu HGO padat.
Meskipun belum dimungkinkan untuk mengendapkan Mercuric Hydroxide Hg (OH)2, Merkuri oksida (II) HGO adalah sesuatu yang larut dalam air yang membentuk larutan spesies yang disebut "hidroksida".
Spesies dalam air yang disebut "hidroksida" ini adalah basis yang lemah dan, meskipun kadang -kadang mereka berperilaku seperti amfotorat, secara umum HG (OH)2 Itu lebih mendasar dari asam.
Saat HGO larut dalam HCLO4 Studi menunjukkan adanya ion merkuri Hg2+, Ion hgoh monohydroximercuro+ dan HG (OH) Mercuric Hydroxide2.
Saldo yang terjadi dalam solusi air seperti itu adalah sebagai berikut:
HG2+ + H2Atau ⇔ hgoh+ + H+
Hgoh+ + H2Atau ⇔ hg (oh)2 + H+
Dalam larutan alkali NaOH, spesies Hg (OH) terbentuk3-.
Memperoleh
Hydroxide merkuri murni
Mercury Hydroxide (II) HG (OH)2 Itu tidak dapat diperoleh dalam larutan air, karena dengan menambahkan alkali ke dalam larutan ion pedagang HG2+, mengendapkan oksida merkuri kuning.
Namun, beberapa peneliti berhasil memperoleh pada tahun 2005 untuk pertama kalinya mercuric hidroksida HG (OH)2 Menggunakan lampu busur merkuri, mulai dari elemen hg merkuri, hidrogen h2 dan oksigen atau2.
 Lampu Merkurius. D-Kuru [CC BY-SA 2.0 at (https: // createveCommons.Org/lisensi/by-sa/2.0/at/deed.di dalam)]. Sumber: Wikipedia Commons.
Lampu Merkurius. D-Kuru [CC BY-SA 2.0 at (https: // createveCommons.Org/lisensi/by-sa/2.0/at/deed.di dalam)]. Sumber: Wikipedia Commons. Reaksinya fotokimia dan dilakukan dengan adanya neon, argon atau deuterium padat pada suhu yang sangat rendah (sekitar 5 K = 5 derajat Kelvin). Bukti pembentukan senyawa diperoleh dengan spektrum serapan cahaya IR (inframerah).
Dapat melayani Anda: endapanHG (oh)2 disiapkan dengan cara ini sangat stabil dalam kondisi pengalaman. Diperkirakan bahwa reaksi fotokimia berlangsung melalui perantara O-HG-O dengan molekul stabil H-O-HG-O-H.
Copresipitasi dengan besi hidroksida (III)
Jika merkuri sulfat (ii) hgso larut4 dan Iman besi sulfat (iii)2(SW4)3 Dalam larutan asam berair, dan pH mulai ditingkatkan dengan menambahkan larutan naoh natrium hidroksida, setelah waktu istirahat padatan yang disimpulkan dibentuk adalah HG (OH) coprecipitated (OH)2 dan iman (oh)3.
Telah ditemukan bahwa pembentukan HG (OH)2 Ini adalah langkah penting dalam copresipitasi ini dengan iman (OH)3.
Pembentukan HG (OH)2 Dalam iman endapan (oh)3-HG (oh)2 Itu sangat tergantung pada keberadaan ion seperti fluoride, klorida atau bromida, pada konsentrasi spesifik ini dan pH larutan.
Di hadapan fluoride (f-), PH lebih besar dari 5, copresipitasi HG (OH)2 Dengan iman (oh)3 tidak terpengaruh. Tetapi untuk pH 4 pembentukan kompleks antara Hg2+ dan f- Mengamput dalam copresipitasi HG (OH)2.
Dalam kasus keberadaan klorida (CL-), Copresipitasi HG (OH)2 Itu terjadi pada pH 7 atau lebih, yaitu, lebih disukai dalam medium alkali.
Saat bromida hadir (br-), Copresipitasi HG (OH)2 Itu muncul pada pH yang bahkan lebih besar, yaitu, pH di atas 8,5, atau lebih basa daripada dengan klorida.
Aplikasi
Dari ulasan sumber informasi yang tersedia, maka Mercury Hydroxide (II) HG (OH)2, Menjadi senyawa yang belum disiapkan secara komersial, ia tidak memiliki kegunaan yang diketahui.
Penelitian terkini
Melalui teknik simulasi komputasi pada tahun 2013 karakteristik struktural dan energi yang terkait dengan hidrasi HG (OH) dipelajari2 Dalam keadaan gas.
Koordinasi logam-ligando dan energi solvasi dihitung dan dibandingkan dengan memvariasikan tingkat hidrasi Hg (OH)2.
Antara lain, ditemukan bahwa tampaknya keadaan oksidasi teoretis adalah 1+, bukan 2+ yang biasanya ditugaskan untuk HG (OH)2.
Dapat melayani Anda: kinerja teoretisRisiko
Meskipun HG (OH)2 Karena itu belum diisolasi dalam kuant yang cukup.
Ini bisa beracun bagi sistem saraf, sistem pencernaan, kulit, mata, sistem pernapasan dan ginjal.
Penghirupan, konsumsi atau kontak dengan kulit senyawa merkuri dapat menyebabkan kerusakan mulai dari iritasi mata dan kulit, insomnia, sakit kepala, tremor, kerusakan pada saluran usus, kehilangan memori, insufisiensi ginjal, antara gejala lainnya.
Merkuri telah diakui secara internasional sebagai polutan. Sebagian besar senyawa merkuri yang bersentuhan dengan lingkungan dimetilasi oleh bakteri yang ada di tanah dan sedimen, membentuk methylmercury.
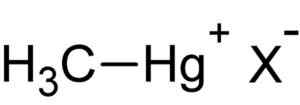 Methylmercury HAL. Penulis: Diunggah oleh Pengguna: Rifleman 82. Sumber: Tidak Diketahui. Sumber: Wikipedia Commons.
Methylmercury HAL. Penulis: Diunggah oleh Pengguna: Rifleman 82. Sumber: Tidak Diketahui. Sumber: Wikipedia Commons. Senyawa ini adalah bioakumula dalam organisme hidup, melewati tanah ke tanaman dan dari sana ke hewan. Di lingkungan akuatik transfer bahkan lebih cepat, melewati spesies yang sangat kecil ke yang besar dalam waktu singkat.
Methylmercury memiliki efek toksik bagi makhluk hidup dan khususnya untuk manusia, yang mencernanya melalui rantai makanan.
Ketika dicerna dengan makanan sangat berbahaya bagi anak kecil dan janin pada wanita hamil, karena menjadi neurotoksin dapat menyebabkan kerusakan otak dan sistem saraf dalam pembentukan dan pertumbuhan.
Referensi
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Wang, Xuefeng dan Andrews, Lester (2005). Spektrum inframerah HG (OH)2 di neon dan argon padat. Kimia Anorganik, 2005, 44, 108-113. Pulih dari pub.ACS.org.
- Amaro-estrada, j.yo., et al. (2013). Solvasi Aqueous HG (OH)2: Studi teori fungsional kerapatan energik dan dinamis dari HG (OH)2-(H2SALAH SATU)N (N = 1-24) Struktur. J. Phys. Chem. Hingga 2013, 117, 9069-9075. Pulih dari pub.ACS.org.
- Inoue, Yoshikazu dan Munemori, Makoto. (1979). Copresipitasi merkuri (II) dengan besi (III) hidroksida. Ilmu & Teknologi Lingkungan. Volume 13, Nomor 4, April 1979. Pulih dari pub.ACS.org.
- Chang, l.W., et al. (2010). Sistem saraf dan toksikologi perilaku. Dalam memahami toksikologi. Pulih dari scientedirect.com.
- Haney, Alan dan Lipsey, Richard L. (1973). Akumulasi dan Efek Metil Merkuri Hidroksida dalam Rantai Makanan Terestraria Di Bawah Kondisi Laboratorium. Lingkungan. Polut. (5) (1973) pp. 305-316. Pulih dari scientedirect.com.
- « Karakteristik Flavin Adenin Dinucleotide (FAD), biosintesis
- Struktur gliseraldehida 3-fosfat (G3P), fungsi »

