Joseph Thomson

- 2678
- 579
- Tommie Smith
 J.J. Thomson
J.J. Thomson Joseph John Thomson (1856-1940) Itu adalah ahli kimia Inggris yang tinggi. Dia memenangkan Hadiah Nobel dalam Fisika pada tahun 1906.
Ia lahir di Cheetam Hill, sebuah distrik Manchester, Inggris, pada 18 Desember 1856. Juga dikenal sebagai "j.J."Thomson belajar teknik di Owens College, saat ini bagian dari University of Manchester, dan kemudian matematika di Cambridge.
Pada 1890, j.J. Thomson menikah dengan Rose Elizabeth Paget, putri Dokter Sir Edward George Paget, dengan siapa dia memiliki dua anak: seorang gadis, bernama Joan Paget Thomson, dan seorang anak, George Paget Thomson.
Yang terakhir akan menjadi ilmuwan terkenal, memperoleh pada tahun 1937 Hadiah Nobel dalam Fisika untuk pekerjaan mereka dengan elektron.
Sejak usia muda, Thomson memfokuskan studinya pada struktur atom, sehingga menemukan keberadaan elektron dan isotop, di antara banyak kontribusi lainnya.
Pada tahun 1906, Thomson menerima Hadiah Nobel dalam Fisika, "sebagai pengakuan atas jasa besar penelitian teoretis dan eksperimentalnya tentang konduksi listrik melalui gas", seperti yang ditetapkan oleh juri dalam vonis Hadiah yang disebutkan di atas ".
Pada tahun 1908, ia diangkat menjadi Knight oleh mahkota Inggris dan menjabat sebagai Profesor Fisika Kehormatan di Cambridge dan Royal Institute, London.
Dia meninggal pada 30 Agustus 1940 pada usia 83, di kota Cambridge, Inggris. Fisikawan dimakamkan di Westminster Abbey, dekat Makam Sir Isaac Newton.
Kontribusi Joseph Thomson untuk Sains dan Kimia
Penemuan elektron
Pada 1897, j.J. Thomson menemukan partikel cahaya baru dari hidrogen, yang dibaptis "elektron".
Itu dapat melayani Anda: penentuan abu: metode dan contohHidrogen dianggap sebagai unit pengukuran berat atom. Sampai saat itu, atom adalah pembagian materi terkecil.
Dalam pengertian ini, Thomson adalah yang pertama menemukan partikel subatomik sel yang dimuat secara negatif.
Model Atom Thomson
Model atom Thomson adalah struktur yang dikaitkan dengan fisikawan Inggris dengan atom. Bagi ilmuwan, atom adalah bidang muatan positif.
Ada elektron yang didistribusikan secara negatif secara merata pada awan beban positif itu, yaitu menetralkan beban positif adonan atom.
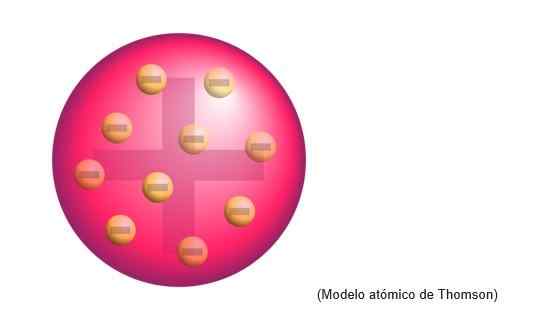
Model baru ini menggantikan yang diuraikan oleh Dalton dan nantinya akan disangkal oleh Rutherford, murid Thomson di laboratorium Cavendish di Cambridge.
Pemisahan atom
Thomson menggunakan sinar positif atau anodik untuk memisahkan atom dari massa yang berbeda. Metode ini memungkinkannya untuk menghitung listrik yang diangkut dengan masing -masing atom dan jumlah molekul per sentimeter kubik.
Mampu membagi atom dari massa dan beban yang berbeda, fisikawan menemukan keberadaan isotop. Juga dengan cara ini, dengan studinya tentang sinar positif, ia menghasilkan kemajuan besar menuju spektrometri massa.
Penemuan isotop
J.J. Thomson menemukan bahwa ion neon memiliki massa yang berbeda, yaitu, berat atom yang berbeda. Beginilah Thomson menunjukkan bahwa neon memiliki dua subtipe isotop, neon-20 dan neon-22.
Isotop, yang dipelajari sampai hari ini, adalah atom dari elemen yang sama, tetapi inti mereka memiliki jumlah massa yang berbeda, karena mereka terdiri dari jumlah neutron yang berbeda di pusatnya.
Eksperimen dengan sinar katoda
Sinar katoda adalah arus elektron dalam tabung vakum, yaitu tabung kaca dengan dua elektroda, satu positif dan satu negatif.
Dapat melayani Anda: kromium hidroksida: struktur, sifat, sintesis, penggunaanKetika elektroda negatif dipanaskan, juga disebut katoda, ia memancarkan radiasi yang diarahkan ke elektroda positif, atau anoda, dalam garis lurus jika tidak ada medan magnet yang terjadi di rute itu.
Jika dinding kaca tabung ditutupi dengan bahan neon, kudeta katoda terhadap lapisan itu menghasilkan proyeksi cahaya.
Thomson mempelajari perilaku sinar katoda dan sampai pada kesimpulan bahwa sinar menyebar lurus.
Dia juga menyimpulkan bahwa sinar ini dapat dialihkan dari lintasan mereka dengan adanya magnet, yaitu, dari medan magnet. Selain itu, sinar dapat menggerakkan bilah dengan kekuatan elektron yang bersirkulasi, sehingga menunjukkan bahwa elektron memiliki massa.
J.J. Thomson mengalami gas di dalam tabung sinar katoda, tetapi perilaku elektron tidak bervariasi. Demikian juga, sinar katoda menghangatkan benda -benda yang diselingi di jalan antar elektroda.
Sebagai kesimpulan, Thomson telah menunjukkan bahwa sinar katoda memiliki efek cahaya, mekanik, kimia dan termal.
Tabung sinar katoda dan sifat cahaya mereka transendental untuk penemuan selanjutnya dari Tube Television (CTR) dan kamera video.
Spektrometer massa
J.J. Thomson menciptakan pendekatan pertama Spektrometer massa. Alat ini memungkinkan studi ilmuwan.
Dengan investigasi ini ia menyimpulkan bahwa sinar katoda terdiri dari sel -sel beban negatif, yang berada di dalam atom, sehingga mendalilkan pembagian atom dan menimbulkan sosok elektron.
Itu dapat melayani Anda: asam butirat: formula, sifat, risiko dan penggunaanJuga, kemajuan dalam spektrometri massa berlanjut hingga hari ini, berevolusi dalam metode yang berbeda untuk memisahkan elektron dari atom.
Selain itu, Thomson adalah orang pertama yang menyarankan Panduan Gelombang Pertama pada tahun 1893. Eksperimen ini terdiri dari penyebaran.
Panduan gelombang akan banyak digunakan di masa depan, bahkan hari ini, dengan transmisi data dan serat optik.
Warisan Thomson
Thomson (TH) didirikan sebagai unit beban massa dalam spektrometri massa, yang diusulkan oleh koki dan bahan kimia rockwood, untuk menghormati Thomson.
Teknik ini memungkinkan untuk menentukan distribusi molekul suatu zat sesuai dengan massa mereka dan, mengenali dengan ini, yang ada dalam sampel materi.
Thomson Formula (TH):
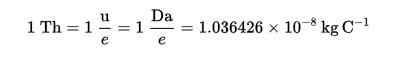
Pekerjaan luar biasa
- Kerusakan listrik melalui gas, listrik melalui gas (1900).
- Teori materi sel -sel, elektron dalam kimia dan ingatan dan refleksi (1907).
- Beyond the Electron (1928).
Referensi
- Nobel Media AB (2014). J. Thomson - Biografi. Penghargaan Nobel.org. Penghargaan Nobel.org.
- Thomson, Joseph J., Listrik Melalui Perilaku Gas. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Pesona partikel dasar yang bijaksana.
- Christen, Hans Rudolf, Dasar -dasar Kimia Umum dan Anorganik, Volume 1. Barcelona, Spanyol. Edisi Reverté s.KE., 1986.
- Arzani, Aurora Cortina, Kimia Umum Dasar. Meksiko, editorial Porrúa, 1967.
- R. G. Koki, a. L. Rockwood. Komunitas Cepat. Spektrom massa. 5, 93 (1991).

