Hukum formula dan unit gas ideal, aplikasi, contoh

- 3908
- 889
- Pete Lesch
Itu Hukum Gas Ideal Ini adalah persamaan negara yang menggambarkan hubungan antara fungsi negara yang terkait dengan gas ideal; seperti suhu, tekanan, volume dan mol. Undang -undang ini memungkinkan untuk mempelajari sistem gas nyata yang membandingkannya dengan versi ideal mereka.
Gas ideal adalah gas teoretis, terdiri dari partikel spesifik atau bola yang bergerak secara acak; Dengan energi kinetik yang hebat, di mana satu -satunya interaksi di antara mereka adalah bentrokan yang benar -benar elastis. Selain itu, mereka mematuhi hukum gas yang ideal.
 Undang -undang Gas Ideal memungkinkan studi dan pemahaman banyak sistem gas nyata. Sumber: Pxhere.
Undang -undang Gas Ideal memungkinkan studi dan pemahaman banyak sistem gas nyata. Sumber: Pxhere. Pada tekanan dan suhu standar (STP): 1 atm tekanan, dan suhu 0 ºC, sebagian besar gas nyata berperilaku kualitatif sebagai gas ideal; asalkan kepadatan mereka rendah. Jarak antarmolekul atau interatomis yang besar (untuk gas mulia) memfasilitasi pendekatan tersebut.
Di bawah kondisi STP oksigen, nitrogen, hidrogen, gas mulia dan beberapa gas senyawa, seperti karbon dioksida, berperilaku seperti gas yang ideal.
Model gas yang ideal cenderung gagal pada suhu rendah, tekanan tinggi, dan kepadatan bagian tinggi; Saat interaksi antarmolekul, serta ukuran partikel, menjadi penting.
Hukum Gas Ideal adalah komposisi dari tiga undang-undang Gase: Hukum Boyle dan Mariotte, Hukum Charles dan Gay-Lussac, dan Hukum Avogadro.
[TOC]
Formula dan Unit

Hukum gas diekspresikan secara matematis dengan formula:
PV = NRT
Dimana p adalah tekanan yang diberikan oleh gas. Biasanya diekspresikan dengan unit atmosfer (ATM), meskipun dapat diekspresikan dalam unit lain: MMHG, Pascal, bar, dll.
Volume V yang ditempati oleh gas biasanya diekspresikan dengan kesatuan liter (L). Ketika N Ini adalah jumlah tahi lalat, r konstanta gas universal, dan t suhu yang dinyatakan dalam Kelvin (k).
Ekspresi yang paling banyak digunakan dalam gas R setara dengan 0,08206 L · atm · k-1· Mol-1. Meskipun unit untuk konstanta gas memiliki nilai 8.3145 j · mol-1· K-1. Keduanya valid selama mereka berhati -hati dengan unit variabel lain (p, t dan v).
Hukum Gas Ideal adalah kombinasi dari Hukum Boyle-Maleotte, Hukum Charles-Gay-Lussac dan Hukum Avogadro.
Hukum Boyle-Maleotte
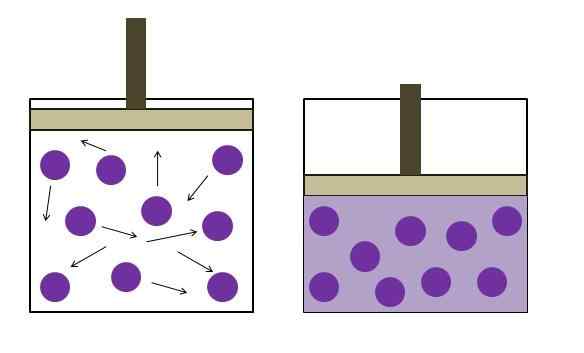 Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar
Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar Itu dirumuskan secara mandiri oleh fisikawan Robert Boyle (1662) dan fisik dan ahli botani Edme Mariotte (1676). Hukum dinyatakan sebagai berikut: Pada suhu konstan, volume massa gas tetap berbanding terbalik dengan tekanan yang diberikannya.
Dapat melayani Anda: terpenosPV ∝ K
Dengan menggunakan dua poin:
P1V1 = P2V2
Hukum Charles-Gay-Lussac
 Lentera atau keinginan Cina. Sumber: Pxhere.
Lentera atau keinginan Cina. Sumber: Pxhere. Undang-undang ini diterbitkan oleh Gay-Lussac pada tahun 1803, tetapi dirujuk ke karya yang tidak diterbitkan oleh Jacques Charles (1787). Karena alasan ini hukum dikenal sebagai Hukum Charles.
Undang -undang menetapkan bahwa pada tekanan konstan, ada rasio langsung proporsionalitas antara volume yang ditempati oleh gas dan suhunya.
V ∝ k2T
Dengan menggunakan dua poin:
V1/T1 = V2/T2
V1T2 = V2T1
Hukum Avogadro
Undang -undang tersebut dinyatakan oleh Amadeo Avogadro pada tahun 1811, mencatat bahwa volume yang sama dari semua gas, pada tekanan dan suhu yang sama, memiliki jumlah molekul yang sama.
V1/N1 = V2/N2
Apa yang menetapkan hukum gas ideal?
Melalui undang -undang gas ideal, hubungan antara empat sifat fisik independen dari gas ditetapkan: tekanan, volume, suhu dan jumlah gas. Sudah cukup untuk mengetahui nilai mereka bertiga, untuk mendapatkan nilai dari yang tersisa.
Undang -undang menetapkan kondisi yang menunjukkan kapan gas berperilaku ideal, dan ketika itu menjauh dari perilaku ini.
Misalnya, faktor kompresi yang disebut SO (PV/NRT) memiliki nilai 1 untuk gas ideal. Nilai nilai 1 untuk faktor kompresi, menunjukkan bahwa perilaku gas menjauh dari gas ideal.
Oleh karena itu, kesalahan akan dilakukan saat menerapkan persamaan gas ideal ke gas yang tidak berperilaku sesuai dengan model.
Aplikasi
Perhitungan kepadatan dan massa molar gas
Persamaan hukum gas ideal dapat digunakan dalam perhitungan kepadatan gas dan massa molarnya. Saat membuat modifikasi sederhana, Anda dapat menemukan ekspresi matematika yang menghubungkan kepadatan (D) dari gas dan massa molar (M):
D = MP/RT
Dan membersihkan m:
M = drt/p
Perhitungan volume gas yang diproduksi dalam reaksi kimia
Stoikiometri adalah cabang kimia yang menghubungkan jumlah masing -masing reagen yang ada dengan produk yang terlibat dalam reaksi kimia, biasanya diekspresikan dalam tahi lalat.
Penggunaan persamaan gas ideal memungkinkan penentuan volume gas yang diproduksi dalam reaksi kimia; Karena, dari reaksi kimia Anda dapat memperoleh jumlah mol. Kemudian, volume gas dapat dihitung:
Dapat melayani Anda: ionomer kaca: persiapan, sifat, jenis, penggunaanPV = NRT
V = nrt/p
Mengukur v dapat menentukan kinerja atau kemajuan reaksi tersebut. Ketika tidak ada lagi gas, itu menunjukkan bahwa reagen telah benar -benar kelelahan.
Perhitungan tekanan parsial gas yang ada dalam campuran
Hukum gas ideal dapat digunakan, bersama dengan hukum tekanan parsial Dalton, untuk menghitung tekanan parsial dari berbagai gas yang ada dalam campuran gas.
Hubungan diterapkan:
P = NRT/V
Untuk menemukan tekanan dari masing -masing gas yang ada dalam campuran.
Volume gas yang dikumpulkan dalam air
Reaksi dibuat yang menghasilkan gas, yang dikumpulkan oleh desain eksperimental dalam air. Tekanan gas total diketahui ditambah tekanan uap air. Nilai yang terakhir dapat diperoleh dalam tabel dan dengan pengurangan tekanan gas dapat dihitung.
Dari stoikiometri reaksi kimia, jumlah mol gas dapat diperoleh, dan menerapkan hubungan:
V = nrt/p
Volume gas yang diproduksi dihitung.
Contoh perhitungan
Latihan 1
Gas memiliki kepadatan 0,0847 g/L hingga 17 ºC, dan tekanan 760 torr. Apa massa molar Anda? Apa gasnya?
Kami mulai dari persamaan
M = drt/p
Kami pertama -tama mengonversi unit suhu ke Kelvin:
T = 17 ºC + 273.15 K = 290.15 K
Dan tekanan 760 torr sesuai dengan 1 atm. Sekarang Anda hanya perlu mengganti nilai dan memecahkan:
M = (0,0847 g/l) (0,08206 L · atm · k-1· Mol-1) (290.15 k) / 1 atm
M = 2.016 g/mol
Massa molar ini dapat sesuai dengan spesies tunggal: molekul hidrogen diatomik, h2.
Latihan 2
Massa 0,00553 g merkuri (Hg) dalam fase gas, berada dalam volume 520 L, dan pada suhu 507 K. Hitung tekanan yang diberikan oleh HG. Massa molar HG adalah 200,59 g/mol.
Masalahnya diselesaikan dengan menggunakan persamaan:
PV = NRT
Informasi tentang jumlah mol Hg tidak muncul; Tetapi mereka dapat diperoleh dengan menggunakan massa molar mereka:
Mol Hg = (0,00553 g Hg) (1 mol Hg/200,59 g)
Dapat melayani Anda: oksigen: sifat, struktur, risiko, penggunaan= 2.757 · 10-5 Mol
Sekarang kita hanya perlu menghapus P dan mengganti nilainya:
P = NRT/V
= (2.757 · 10-5 mol) (8.206 · 10-2 L · atm · k-1· Mol-1) (507 k)/ 520 l
= 2.2 · 10-6 ATM
Latihan 3
Hitung tekanan yang dihasilkan oleh asam klorida yang diproduksi dengan bereaksi 4,8 g gas klor (CL2) dengan gas hidrogen (h2), Dalam volume 5,25 L, dan pada suhu 310 K. Massa molar CL2 adalah 70,9 g/mol.
H2 g) + Cl2 g) → 2 HCl(G)
Masalahnya diselesaikan dengan menggunakan persamaan gas ideal. Tetapi jumlah HCl diekspresikan dalam gram dan bukan pada tahi lalat, jadi transformasi yang jatuh tempo dibuat.
Mol hcl = (4,8 g cl2) (1 mol Cl2/70.9 g cl2) (2 mol HCl/1mol CL2)
= 0,135 mol HCl
Menerapkan persamaan undang -undang gas ideal:
PV = NRT
P = NRT/V
= (0,135 mol HCl) (0,08206 L · atm · k-1· Mol-1) (310 k) / 5.25 l
= 0,65 atm
Latihan 4
Sampel 0,130 g senyawa gas menempati volume 140 mL pada suhu 70 ºC dan pada tekanan 720 torr. Apa massa molar Anda?
Untuk menerapkan persamaan Gase yang ideal, beberapa perubahan harus terlebih dahulu:
V = (140 ml) (1 L/1000 mL)
= 0,14 l
Memiliki volume dalam liter, sekarang Anda harus mengekspresikan suhu di Kelvin:
T = 70 ºC + 273.15 K = 243.15 K
Dan akhirnya, kita harus mengubah tekanan menjadi unit atmosfer:
P = (720 torr) (1 atm/760 torr)
= 0,947 atm
Langkah pertama dalam menyelesaikan masalah adalah mendapatkan jumlah mol dari senyawa. Untuk ini, persamaan gas ideal digunakan dan kami dibersihkan N:
PV = NRT
N = PV / RT
= (0,947 atm) (0,14 L) / (0,08206 L · atm · k-1· Mol-1) (243.15 k)
= 0,067 mol
Hanya perlu untuk menghitung adonan molar dengan membagi gram di antara tahi lalat yang diperoleh:
Massa molar = gram senyawa / jumlah mol.
= 0,130 g / 0,067 mol
= 19.49 g/mol
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Iran. Levine. (2014). Prinsip -prinsip fisikokimia. Edisi Keenam. MC Graw Hill.
- Glasstone. (1970). Perjanjian Kimia Fisik. Edisi kedua. Aguilar.
- Mathews, c. K., Van Holde, K. DAN., Dan Ahern, k. G. (2002). Biokimia. 3dulu Edisi. Editorial Pearson Addison Wesley.
- Wikipedia. (2019). Gas Ideal. Diperoleh dari: di.Wikipedia.org
- Tim editorial. (2018). Hukum Boyle atau Hukum Boyle-Maleotte | Hukum gas. Pulih dari: iquimicas.com
- Jessie a. Kunci. (S.F.). Hukum Gas Ideal dan Sub Aplikasi. Diperoleh dari: OpenTextBC.Ac

