Myoglobin

- 2130
- 625
- Ray Thiel
 Struktur mioglobin
Struktur mioglobin Apa itu mioglobin?
Itu Myoglobin Ini adalah protein globular intraseluler yang ditemukan dalam sitosol sel otot kerangka dan jantung. Fungsi mendasarnya adalah membentuk cadangan oksigen dan mendukung transportasi oksigen intraseluler.
John Kendrew dan Max Perutz menerima Hadiah Nobel dalam Kimia pada tahun 1962 untuk studi mereka tentang protein globular. Para penulis ini menjelaskan struktur tiga dimensi mioglobin dan hemoglobin, masing -masing. Secara historis mioglobin adalah salah satu protein pertama yang ditentukan oleh struktur tiga dimensi.
Protein globular adalah molekul kompak dengan bentuk bola; Mereka larut dalam sitosol atau di bagian lipid membran sel. Mereka bertanggung jawab atas tindakan biologis utama, yang bertentangan dengan protein berserat, yang fungsi utamanya bersifat struktural.
Myoglobin memberi daging segar merah. Ini terjadi ketika mioglobin dioksigenasi sebagai oximioglobin dan zat besi yang menyusunnya dalam besi besi: MB-FE2+O2.
Ketika daging terpapar pada lingkungan, besi, tidak stabil, teroksidasi dan menjadi besi dan dalam kondisi ini warna berubah menjadi nada coklat untuk pembentukan metamioglobin (MB-FE3 + + O2 ●-).
Biasanya kadar myglobin darah sangat kecil, mereka berada dalam urutan mikrogram per liter (μg/L). Tingkat -kadar ini meningkat ketika kerusakan otot terjadi seperti pada rhabdomyolysis otot rangka atau dalam kasus infark jantung dengan kerusakan jaringan dan dalam beberapa miopati.
Kehadirannya dalam urin diamati dalam kondisi tertentu di mana kerusakan jaringan sangat penting. Nilai diagnostik awal untuk infark jantung bisa diperdebatkan.
Dapat melayani Anda: inti selStruktur mioglobin
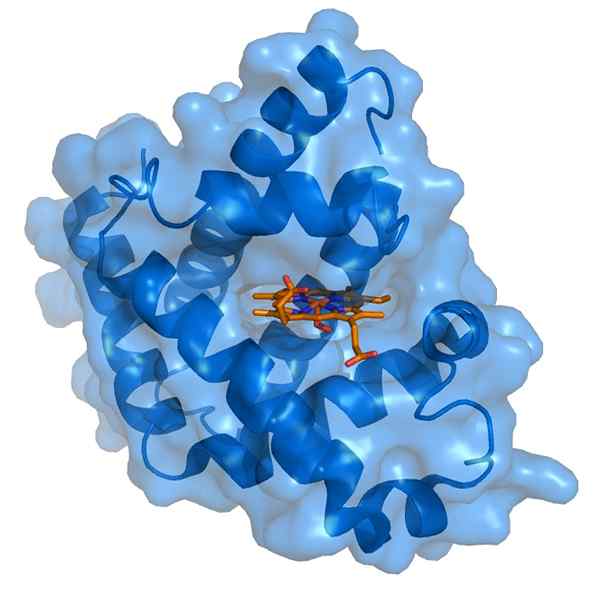 Myoglobin dan kelompok prostetik hemo-nya (Sumber: Thomas Spletttsser/CC BY-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons)
Myoglobin dan kelompok prostetik hemo-nya (Sumber: Thomas Spletttsser/CC BY-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) Mioglobin memiliki berat molekul hampir 18 kDa termasuk kelompok hemo. Itu terdiri dari empat segmen heliks yang disatukan oleh "belokan tiba -tiba". Baling -baling mioglobin ini dikemas erat dan mempertahankan integritas struktural mereka bahkan ketika kelompok hemo dihilangkan.
Struktur protein globular, serta semua protein sel, bersifat hierarkis, sehingga struktur mioglobin juga. Tingkat pertama adalah struktur utama yang dibentuk oleh urutan linier asam amino dan mioglobin terdiri dari rantai asam amino 153.
Struktur sekunder mioglobin terdiri dalam pembentukan baling -baling alfa. Myoglobin berisi 8 baling -baling alfa yang dibentuk oleh bagian polipeptida berulang yang mengikat dengan segmen manajemen aperiadic pendek.
Struktur tersier terdiri dari konformasi tiga dimensi dengan aktivitas biologis. Karakteristik terpenting dari struktur ini adalah lipat. Struktur Kuarter mengacu pada perakitan dua atau lebih rantai polipeptida yang terpisah dan bersatu melalui tautan atau interaksi non -kovalen.
Mioglobin memiliki struktur yang sangat kompak, dengan limbah hidrofobik diarahkan ke residu interior dan hidrofilik atau polar yang diarahkan ke luar. Limbah apolar internal dibentuk oleh leusin, valin, metode dan fenilalanin. Satu -satunya limbah kutub internal adalah dua histidin yang memiliki fungsi di pusat aktif.
Kelompok prostetik hemo terletak di celah bagian dalam apolar dari rantai polyloglobin polipeptida. Kelompok ini mengandung zat besi dalam bentuk besi besi, yang berikatan dengan oksigen untuk membentuk oximioglobin.
Dapat melayani Anda: GLUT4: Karakteristik, Struktur, FungsiFungsi myoglobin
Fungsi mioglobin adalah untuk menyatukan oksigen dengan kelompok hemo dari strukturnya dan membentuk cadangan oksigen untuk fungsi otot. Sejauh oksigen terperangkap dalam struktur mioglobin dalam sitoplasma sel otot, tekanan intraselulernya, ditentukan oleh oksigen bebas, tetap rendah.
Tekanan oksigen intraseluler rendah mempertahankan gradien untuk inlet oksigen ke sel. Ini mendukung lewat oksigen dari torrent peredaran darah ke sel otot. Saat mioglobin jenuh oksigen intraseluler meningkat, yang semakin mengurangi gradien dan dengan demikian mengurangi transfer.
Kurva pengikat oksigen ke mioglobin adalah hiperbolik. Pada bagian awal kurva, perubahan kecil dalam tekanan oksigen parsial menghasilkan perubahan besar dalam saturasi mioglobin dengan oksigen.
Kemudian, sejauh tekanan oksigen parsial meningkat saturasi terus meningkat, tetapi lebih lambat, yaitu, peningkatan yang jauh lebih besar dalam tekanan oksigen parsial diperlukan untuk meningkatkan saturasi mioglobin, dan secara progresif kurva meratakan.
Ada variabel yang mengukur afinitas kurva yang disebut P50, ini mewakili tekanan parsial oksigen yang diperlukan untuk menjenuhkan mioglobin yang terkandung dalam larutan sebesar 50%. Jadi, jika P50 meningkat, dikatakan bahwa mioglobin memiliki afinitas yang lebih sedikit dan jika P50 berkurang, dikatakan bahwa mioglobin memiliki afinitas yang lebih besar terhadap oksigen.
Dapat melayani Anda: proeritroblas: karakteristik, morfologi, regulasi, pewarnaanKetika kurva pengikat oksigen dengan mioglobin dan hemoglobin diperiksa, diamati bahwa untuk tekanan oksigen parsial apa pun, mioglobin jenuh daripada hemoglobin, menunjukkan bahwa mioglobin memiliki afinitas yang lebih besar untuk oksigen daripada oksigen daripada hemoglobin.
Jenis serat otot dan mioglobin
Otot rangka memiliki berbagai jenis serat otot dalam komposisinya, beberapa panggilan kontraksi lambat dan yang lainnya dari kontraksi cepat. Serat kontraksi cepat secara struktural dan metabolik disesuaikan untuk berkontraksi dengan cepat dan kuat dan dengan cara anaerobik.
Serat kontraksi lambat diadaptasi untuk kontraksi berkecepatan rendah, tetapi lebih lama, khas dari latihan resistensi aerobik. Salah satu perbedaan struktural dari serat ini adalah konsentrasi mioglobin, yang memberi mereka nama serat putih dan merah.
Serat merah memiliki kandungan mioglobin yang tinggi, yang memberi mereka warna merah, tetapi yang juga memungkinkan mereka untuk mempertahankan oksigen dalam jumlah besar, yang sangat diperlukan untuk fungsinya.
Nilai normal
Nilai darah normal untuk pria berasal dari 19 hingga 92 μg/L dan pada wanita dari 12 hingga 76 μg/L, namun, ada perbedaan nilai di laboratorium yang berbeda.
Nilai -nilai ini meningkat ketika kerusakan otot terjadi seperti pada rhabdomyolysis otot rangka, dalam luka bakar yang luas, sengatan listrik atau pada nekrosis otot yang luas karena oklusi arteri, pada infark miokard dan dalam beberapa miopati miopati,.
Dalam kondisi ini mioglobin muncul dalam urin dan memberikannya warna yang khas.

