Model Atom Broglie

- 1707
- 92
- Irvin Reichel
Dia Model Atom Broglie Itu diusulkan oleh fisikawan Prancis Louis Broglie pada tahun 1924. Dalam tesis doktoralnya, Broglie mengatakan dualitas gelombang elektron, meletakkan fondasi mekanika bergelombang. Broglie menerbitkan temuan teoretis penting tentang sifat gelombang-corpusculus.
Pernyataan Broglie kemudian ditunjukkan secara eksperimental oleh para ilmuwan Clinton Davisson dan Lester Germer, pada tahun 1927. Teori Gelombang Elektron Broglie didasarkan pada proposal Einstein tentang sifat -sifat cahaya yang bergelombang dalam panjang gelombang pendek.
 Louis Broglie
Louis Broglie Broglie mengumumkan kemungkinan bahwa materi memiliki perilaku yang mirip dengan cahaya, dan menyarankan sifat serupa dalam partikel subatomik seperti elektron.
Beban listrik dan orbit membatasi amplitudo, panjang dan frekuensi gelombang yang dijelaskan oleh elektron. Broglie menjelaskan pergerakan elektron di sekitar inti atom.
[TOC]
Karakteristik model atom Broglie
Untuk mengembangkan proposal mereka, Broglie mulai dari prinsip bahwa elektron memiliki sifat ganda antara gelombang dan partikel, mirip dengan cahaya.
Dalam pengertian itu, Broglie membuat perumpamaan antara dua fenomena, dan berdasarkan persamaan yang dikembangkan oleh Einstein untuk studi tentang sifat cahaya yang bergelombang, kata yang berikut:
- Energi total foton dan, akibatnya, energi total elektron, hasil dari produk frekuensi gelombang dan konstanta papan (6.62606957 (29) × 10 -3. 4 Jules x detik), sebagaimana dirinci dalam ungkapan berikut:

Dalam ungkapan ini:
E = Energi Elektron.
H = konstanta papan.
F = frekuensi gelombang.
- Momen linier foton, dan oleh karena itu, elektron, berbanding terbalik dengan panjang gelombang, dan kedua besaran terkait melalui konstanta papan:
Dapat melayani Anda: osmosis terbalik: cara kerjanya, untuk apa, contohnya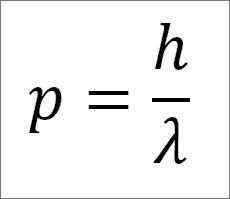
Dalam ungkapan ini:
P = momen linear elektron.
H = konstanta papan.
λ = panjang gelombang.
- Momen linier adalah produk dari massa partikel karena kecepatan yang dimiliki partikel selama perpindahannya.
Jika ekspresi matematika sebelumnya direstrukturisasi tergantung pada panjang gelombang, berikut ini adalah:
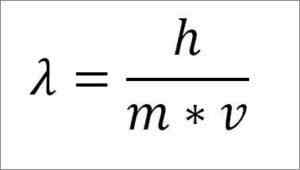
Dalam ungkapan itu:
λ = panjang gelombang.
H = konstanta papan.
m = massa elektron.
V = Kecepatan Elektron.
Karena h, konstanta papan, memiliki nilai kecil, panjang gelombang λ juga. Akibatnya, layak untuk menyatakan bahwa sifat gelombang elektron disajikan hanya pada tingkat atom dan subatomik.
- Broglie juga didasarkan pada postulat model atom bohr. Menurut yang terakhir, orbit elektron terbatas dan hanya dapat menjadi kelipatan bilangan bulat. Jadi:
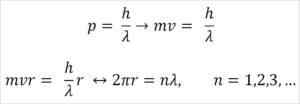
Di mana:
λ = panjang gelombang.
H = konstanta papan.
m = massa elektron.
V = Kecepatan Elektron.
R = Radius Orbit.
n = bilangan bulat.
Menurut model atom Bohr, yang diadopsi Broglie sebagai pangkalan, jika elektron berperilaku sebagai gelombang stasioner, satu -satunya orbit yang diizinkan adalah mereka yang jari -jarinya sama dengan seluruh kelipatan panjang gelombang λ.
Oleh karena itu, tidak semua orbit mematuhi parameter yang diperlukan untuk elektron untuk memobilisasi melalui ini. Inilah mengapa elektron hanya bisa bergerak dalam orbit tertentu.
Teori gelombang elektron Broglie membenarkan keberhasilan model atom Bohr untuk menjelaskan perilaku elektron unik dari atom hidrogen.
Dapat melayani Anda: baterai keringDemikian pula, ia juga memberi lampu mengapa model ini tidak menyesuaikan diri dengan sistem yang lebih kompleks, yaitu atom dengan lebih dari satu elektron.
Eksperimen Davisson dan Jern
Pemeriksaan eksperimental model atom Broglie berlangsung 3 tahun kemudian dari publikasi, pada tahun 1927.
Fisikawan AS yang terkemuka Clinton J. Davisson dan Lester Germer secara eksperimental mengkonfirmasi teori mekanika bergelombang.
Davisson dan Jerman melakukan uji dispersi balok elektron melalui kristal nikel dan mengamati fenomena difraksi melalui lingkungan logam.
Percobaan yang dilakukan terdiri dari melaksanakan prosedur berikut:
- Pada contoh pertama, rakitan dengan balok elektron ditempatkan yang memiliki energi awal yang diketahui.
- Sumber tegangan dipasang untuk mempercepat gerakan elektron yang menghasut perbedaan potensial.
- Aliran balok elektron ke kaca logam diarahkan; Dalam hal ini, nikel.
- Jumlah elektron yang menabrak kaca nikel diukur.
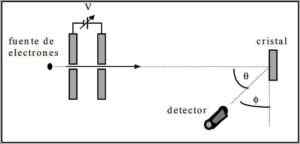
Di akhir eksperimen, Davisson dan Jerman mendeteksi bahwa elektron tersebar ke arah yang berbeda.
Saat mengulangi percobaan menggunakan kristal logam dengan orientasi yang berbeda, para ilmuwan mendeteksi yang berikut:
- Dispersi balok elektron melalui kaca logam sebanding dengan fenomena gangguan dan difraksi sinar cahaya.
- Refleksi elektron pada kaca dampak menggambarkan lintasan yang, secara teoritis, harus menggambarkan menurut teori gelombang elektron broglie.
Singkatnya, eksperimen Davisson dan Jerman secara eksperimental membuktikan sifat elektron gelombang ganda.
Dapat melayani Anda: tautan kovalen kutub: karakteristik dan contohBatasan
Model atom Broglie tidak memprediksi lokasi yang tepat dari elektron pada orbit di mana ia bergerak.
Dalam model ini, elektron dianggap sebagai gelombang yang dimobilisasi di seluruh orbit tanpa lokasi tertentu, yang memperkenalkan konsep orbital elektronik.

Selain itu, model atom Broglie, analog dengan model Schrödinger, tidak mempertimbangkan rotasi elektron pada sumbu yang sama (putaran).
Dengan mengabaikan momentum sudut elektron intrinsik, variasi spasial dari partikel -partikel subatomik ini disisihkan.
Dalam urutan ide yang sama, model ini juga tidak memperhitungkan perubahan dalam perilaku elektron cepat sebagai akibat dari efek relativistik.
Artikel yang menarik
Model Atom Schrödinger.
Model Atom Chadwick.
Model Atom Heisenberg.
Model Atom Perrin.
Model Atom Thomson.
Model Atom Dalton.
Dirac Jordan Atomic Model.
Model Atom Demokritus.
Model Atom Leucipo.
Model Atom Bohr.
Model atom saat ini.
Referensi
- BOHR's Quantum Theory dan de Broglie Waves (S.F.). Pulih dari: ne.Phys.Kyushu-u.Ac.J
- Louis de Broglie - Biografi (1929). © The Nobel Foundation. Pulih dari: nobelprize.org
- Louis-Victor de Broglie (S.F.). Diperoleh dari: chemed.Chem.Purdue.Edu
- Lovett, b. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Dipulihkan dari: Britannica.com
- De broglie model atom. Universitas Pendidikan Jarak Jauh Nasional. Spanyol. Pulih dari: ocw.Innova.Uned.adalah
- Louis de Broglie.F.). Pulih dari: hiru.Eus
- Von Pamel, atau., Dan Marchisio, s. (S.F.). Mekanika kuantum. Universitas Nasional Rosario. Pulih dari: fceia.a r.Edu.ar

