Karakteristik model atom sommerfeld, postulat, kelebihan dan kekurangan
- 3734
- 96
- Miss Wm Hudson
Dia Model Atom Sommerfeld Itu diciptakan oleh fisikawan Jerman Arnold Sommerfeld antara tahun 1915 dan 1916, untuk menjelaskan fakta -fakta bahwa model Bohr, yang dirilis sesaat sebelumnya pada tahun 1913, tidak dapat menjelaskan dengan memuaskan. Sommerfeld mempresentasikan hasilnya terlebih dahulu ke Bavaria Academy of Sciences dan kemudian menerbitkannya di majalah Annalen der Physik.
Model atom yang diusulkan oleh fisikawan Denmark Niels Bohr menggambarkan.
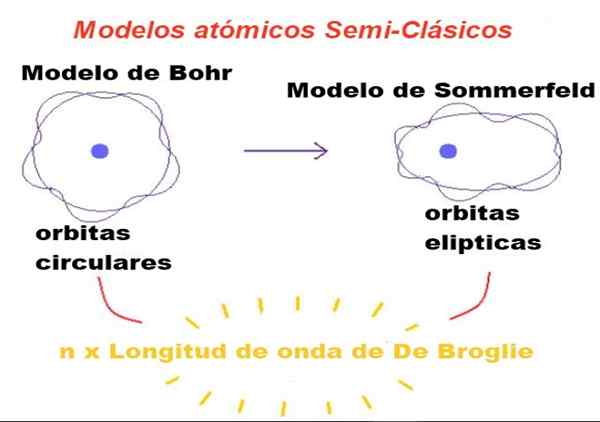
 Gambar 1. Dalam model semi-klasik, orbit adalah orang Newton, tetapi hanya mereka yang perimeternya adalah bilangan bulat beberapa kali panjang gelombang broglie diizinkan. Sumber: f. Zapata.
Gambar 1. Dalam model semi-klasik, orbit adalah orang Newton, tetapi hanya mereka yang perimeternya adalah bilangan bulat beberapa kali panjang gelombang broglie diizinkan. Sumber: f. Zapata. Dalam teori yang diusulkan oleh Bohr, elektron yang mengorbit di sekitar nukleus hanya dapat memiliki nilai -nilai tertentu dari momen sudut orbitalnya, dan karena itu tidak dapat berada di orbit apa pun.
Bohr juga menganggap bahwa orbit ini melingkar dan nomor kuantum tunggal yang disebut Nomor kuantum utama n = 1, 2, 3 ... berfungsi untuk mengidentifikasi orbit yang diizinkan.
Modifikasi pertama yang diperkenalkan oleh Sommerfeld ke model Bohr terdiri dari dengan asumsi bahwa orbit elektron juga dapat menjadi elips.
Sebuah keliling dijelaskan oleh jari -jarinya, tetapi untuk elips Anda harus memberikan dua parameter: semi -senije dan setengah -semi, selain orientasi spasial yang sama. Dengan ini ia memperkenalkan dua angka kuantum lagi.
Modifikasi utama kedua yang dibuat Sommerfeld adalah menambahkan efek relativistik ke model atom. Tidak ada yang lebih cepat dari cahaya, namun Sommerfeld telah menemukan elektron dengan kecepatan yang cukup dekat, oleh karena itu perlu untuk menggabungkan efek relativistik dalam deskripsi atom apa pun.
[TOC]
Deposulat Model Atom Sommerfeld
Elektron mengikuti orbit melingkar dan elips
Elektron dalam atom mengikuti orbit elips (orbit melingkar adalah kasus tertentu) dan status energinya dapat ditandai dengan 3 angka kuantum: angka kuantum utama N, Angka kuantum sekunder atau nomor azimutal l dan angka kuantum magnetik ML.
Dapat melayani Anda: garam binerBerbeda dengan keliling, elips memiliki semije yang lebih besar dan setengah kecil.
Tapi elips dengan semi -sumbu yang sama, mereka dapat memiliki setengah -semi kecil yang berbeda, tergantung pada tingkat eksentrisitas. Eksentrisitas yang sama dengan 0 sesuai dengan lingkaran, sehingga tidak mengesampingkan lintasan melingkar. Selain itu, dalam elips ruang dapat memiliki kecenderungan yang berbeda.
Itulah sebabnya Sommerfeld menambahkan ke modelnya angka kuantum sekunder L untuk menunjukkan setengah minor dan angka kuantum magnetik mL. Dengan demikian dia menunjukkan apa orientasi spasial orbit elips yang diizinkan.
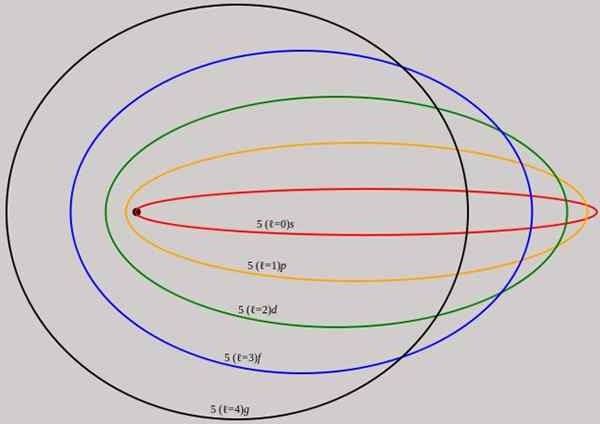 Gambar 2. Orbit yang sesuai dengan tingkat energi n = 5 ditampilkan untuk momentum sudut yang berbeda yang memiliki panjang gelombang lengkap de broglie. Sumber: Wikimedia Commons.
Gambar 2. Orbit yang sesuai dengan tingkat energi n = 5 ditampilkan untuk momentum sudut yang berbeda yang memiliki panjang gelombang lengkap de broglie. Sumber: Wikimedia Commons. Perhatikan bahwa itu tidak menambahkan angka kuantum utama baru, jadi energi total elektron dalam orbit elips sama seperti pada model Bohr. Oleh karena itu tidak ada tingkat energi baru, tetapi pembukaan level yang diberikan oleh angka n.
Efek Zeeman dan Efek yang mencolok
Dengan cara ini dimungkinkan untuk sepenuhnya menentukan orbit yang diberikan, berkat 3 angka kuantum yang disebutkan dan dengan demikian menjelaskan keberadaan dua efek: efek zeeman dan efek yang mencolok.
Maka menjelaskan pembukaan energi yang muncul dalam efek Zeeman normal (ada juga efek zeeman anomali), di mana garis spektral dibagi menjadi beberapa komponen ketika berada di hadapan medan magnet.
Terbuka garis -garis ini juga terjadi di hadapan medan listrik, yang dikenal sebagai efek yang jelas, yang membuat Sommerfeld memikirkan modifikasi model Bohr untuk menjelaskan efek ini.
Inti atom dan elektron bergerak di sekitar pusat massanya
Setelah Ernest Rutherford menemukan nukleus atom dan bahwa fakta bahwa hampir seluruh massa atom terkonsentrasi di sana, para ilmuwan percaya bahwa nukleus itu lebih atau kurang stasioner.
Itu dapat melayani Anda: lithium hidroksida (lioh)Namun, Sommerfeld mendalilkan bahwa nukleus dan elektron dalam orbit bergerak di sekitar pusat massa sistem, yang tentu saja sangat dekat dengan nukleus. Modelnya menggunakan massa yang dikurangi dari sistem inti elektron, bukan massa elektron.
Dalam orbit elips, seperti halnya planet -planet di sekitar matahari, ada saat -saat ketika elektron lebih dekat, dan pada orang lain lebih jauh dari nukleus. Oleh karena itu kecepatannya berbeda di setiap titik orbitnya.
 Gambar 3.- Arnold Sommerfeld. Sumber: Wikimedia Commons. Gfhund [cc by 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)].
Gambar 3.- Arnold Sommerfeld. Sumber: Wikimedia Commons. Gfhund [cc by 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Elektron dapat mencapai kecepatan relativistik
Sommerfeld Diperkenalkan ke dalam modelnya konstanta struktur halus, konstanta tanpa dimensi terkait dengan gaya elektromagnetik:
α = 1/137.0359895
Itu didefinisikan sebagai hasil bagi antara beban elektron Dan Saya persegi tinggi, dan produk antara konstanta Planck H dan kecepatan cahaya C Dalam ruang hampa, semuanya dikalikan dengan 2π:
α = 2π (e2/H.c) = 1/137.0359895
Konstanta struktur halus menghubungkan tiga konstanta terpenting dari fisika atom. Yang lainnya adalah massa elektron, yang tidak muncul di sini.
Dengan cara ini terkait dengan elektron dengan foton (yang bergerak pada kecepatan C dalam kekosongan), dan dengan demikian menjelaskan penyimpangan beberapa garis spektral atom hidrogen dari prediksi oleh model Bohr.
Berkat koreksi relativistik, tingkat energi dengan setara N Tapi berbeda l Mereka terpisah, memunculkan struktur struktur yang halus, dari sana nama α konstan.
Dan semua panjang karakteristik atom dapat diekspresikan dalam hal konstan ini.
 Gambar 4. Kuantisasi momentum sudut ditampilkan. Tidak seperti orbit melingkar, elips. Sumber: f. Zapata.
Gambar 4. Kuantisasi momentum sudut ditampilkan. Tidak seperti orbit melingkar, elips. Sumber: f. Zapata. Keuntungan dan kerugian
Keuntungan
-Sommerfeld menunjukkan bahwa jumlah kuantum tunggal tidak cukup untuk menjelaskan garis spektral atom hidrogen.
-Itu adalah model pertama yang mengusulkan kuantisasi spasial, karena proyeksi orbit ke arah medan elektromagnetik, pada dasarnya, dikuantisasi.
Dapat melayani Anda: keadaan plasma: karakteristik, jenis dan contoh-Model Sommerfeld dengan memuaskan menjelaskan bahwa elektron dengan angka kuantum utama yang sama berbeda dalam keadaan energi mereka, karena mereka dapat memiliki angka kuantum yang berbeda L dan mL.
-Memperkenalkan α konstan untuk mengembangkan struktur halus spektrum atom dan menjelaskan efek Zeeman.
-Itu termasuk efek relativistik, karena elektron dapat bergerak dengan kecepatan cukup dekat dengan cahaya.
Kerugian
-Modelnya hanya berlaku untuk atom dengan elektron dan dalam banyak hal untuk atom logam alkali seperti Li2+, Tetapi tidak berguna dalam atom helium, yang memiliki dua elektron.
-Tidak menjelaskan distribusi elektronik dalam atom.
-Model yang diizinkan untuk menghitung energi dari negara -negara yang diizinkan dan frekuensi radiasi yang dikeluarkan atau diserap dalam transisi antar negara, tanpa memberikan informasi tentang waktu transisi ini.
-Sekarang diketahui bahwa elektron tidak mengikuti lintasan dengan bentuk yang telah ditentukan sebagai orbit, tetapi mereka menempati Orbital, Daerah luar angkasa yang sesuai dengan solusi persamaan Schrodinger.
-Model ini secara sewenang -wenang menggabungkan aspek klasik dengan aspek kuantum.
-Dia gagal menjelaskan efek zeeman anomali, karena ini diperlukan oleh model Dirac, yang kemudian menambahkan angka kuantum lain.
Artikel yang menarik
Model Atom Schrödinger.
Model Atom Broglie.
Model Atom Chadwick.
Model Atom Heisenberg.
Model Atom Perrin.
Model Atom Thomson.
Model Atom Dalton.
Dirac Jordan Atomic Model.
Model Atom Leucipo.
Model Atom Bohr.
Model atom saat ini.
Referensi
- Brainkart. Sommerfeld Atom Model dan kelemahannya. Pulih dari: Brainkart.com.
- Bagaimana kami mengetahui kosmos: cahaya & materi. Atom Sommerfeld. Diperoleh dari: Tastargarden.bersama.Inggris
- Parker, hlm. Atom Bohr-Sommerfeld. Pulih dari: physnet.org
- Sudut pendidikan. Model Sommerfeld. Pulih dari: rinconucative.com.
- Wikipedia. Model Atom Sommerfeld. Pulih dari: is.Wikipedia, org.

