Struktur perak nitrat (AGNO3), sifat, penggunaan, toksisitas

- 2323
- 84
- Miss Wm Hudson
Dia perak nitrat Ini adalah garam anorganik yang formula kimianya adalah Agno3. Dari semua garam perak, itu adalah yang paling ekonomis dan yang menghadirkan stabilitas relatif terhadap sinar matahari, sehingga cenderung lebih sedikit untuk membusuk. Ini adalah sumber perak yang larut dan predilect di setiap laboratorium pengajaran atau penelitian.
Dalam mengajar, solusi nitrat perak berair digunakan untuk mengajarkan reaksi presipitasi perak klorida. Demikian juga, solusi ini dihubungi dengan tembaga logam untuk terjadi reaksi rédox, di mana perak logam mengendap di tengah -tengah pembubaran yang terbentuk dari tembaga nitrat, Cu (NO3)2.
 Wadah sampel nitrat perak. Sumber: w. Oelen/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/3.0)
Wadah sampel nitrat perak. Sumber: w. Oelen/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/3.0) Di gambar atas botol dengan nitrat perak ditampilkan. Itu dapat tetap terpapar cahaya tanpa semakin gelap kristal, produk dari penampilan perak oksida.
Mengikuti kebiasaan alkimia, dan sifat antibakteri perak logam, perak nitrat telah digunakan untuk mendisinfeksi dan membasahi luka. Namun, untuk tujuan ini larutan air yang sangat encer digunakan, atau padatan dicampur dengan kalium nitrat yang diaplikasikan oleh ujung batang kayu.
[TOC]
Struktur nitrat perak
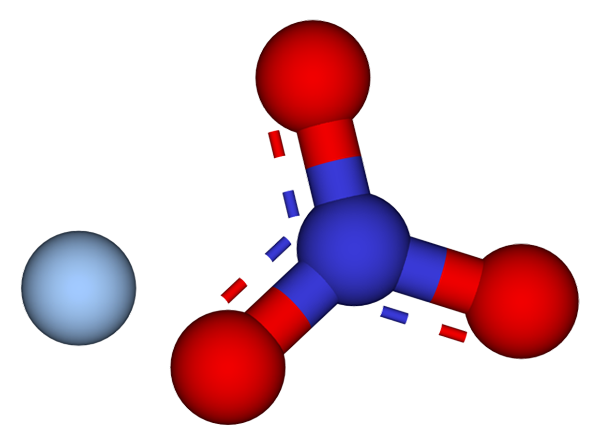 Ion yang membentuk kristal nitrat perak. Sumber: CCOIL/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/3.0)
Ion yang membentuk kristal nitrat perak. Sumber: CCOIL/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Pada gambar atas, ion Ag ditampilkan+ dan tidak3- dari perak nitrat, yang diwakili oleh model bola dan batang. Formula Agno3 menunjukkan proporsi stoikiometrik dari garam ini: untuk setiap kation ag+ Tidak ada anion3- berinteraksi dengannya secara elektrostatis.
Itu dapat melayani Anda: belerang: sejarah, sifat, struktur, mendapatkan, menggunakanAnion no3- (Bola merah dan kebiruan) memiliki geometri datar trigonal, dengan beban negatif yang membongkar antara tiga atom oksigennya. Oleh karena itu, interaksi elektrostatik antara kedua ion terjadi secara khusus antara kation ag+ dan atom oksigen anion tidak3- (Ag+-ATAU TIDAK2-).
Dengan cara ini, setiap AG+ akhirnya mengoordinasikan atau mengelilingi tiga tidak3- berdekatan di bidang yang sama atau lapisan kristalografi. Pengelompokan bidang -bidang ini akhirnya mendefinisikan kristal yang strukturnya beraruhan.
Persiapan
Nitrat perak disiapkan dengan menyerang potongan perak logam yang terbakar dengan asam nitrat, baik dingin, atau terkonsentrasi panas:
3 Ag + 4 hno3 (diencerkan) → 3 Agno3 + 2 h2O +tidak
Ag + 2 hno3 (terkonsentrasi) → Agno3 + H2O +tidak2
Perhatikan pembentukan gas tidak dan tidak2, yang beracun, dan memaksa reaksi ini untuk tidak dilakukan di luar lonceng ekstraktor.
Sifat fisik dan kimia
Penampilan fisik
Solid kristal yang tidak berwarna, toilet, tetapi rasanya sangat pahit.
Masa molar
169.872 g/mol
Titik lebur
209.7 ºC
Titik didih
440 ºC. Namun, pada suhu ini mengalami dekomposisi termal, di mana perak logam terjadi:
2 Agno3(L) → 2 Ag (S) + O2 (g) + 2 Tidak2 (G)
Tidak ada uap Agno3, Setidaknya tidak dalam kondisi terestrial.
Kelarutan
Agno3 Ini adalah penghematan air yang sangat larut, memiliki kelarutan 256 g/ 100 ml pada 25 ° C. Ini juga larut dalam pelarut polar lainnya seperti amonia, asam asetat, aseton, eter dan gliserol.
Kepadatan
4.35 g/cm3 pada 24 ºC (suhu sekitar)
Dapat melayani Anda: air suling3,97 g/cm3 pada 210 ºC (tepat di titik leleh)
Stabilitas
Agno3 Itu adalah zat yang stabil setiap kali disimpan dengan benar. Itu tidak akan meradang pada suhu apa pun, meskipun dapat dipecah dengan melepaskan nitrogen oksida asap beracun.
Di sisi lain, meskipun perak nitrat tidak mudah terbakar, itu adalah agen pengoksidasi yang kuat yang, ketika bersentuhan dengan bahan organik dan sumber panas, mampu memicu reaksi eksotermik dan eksplosif.
Selain itu, garam ini tidak boleh diekspos terlalu banyak waktu untuk sinar matahari, karena kristal mereka gelap karena pembentukan perak oksida.
Penggunaan nitrat perak
Agen pencetus dan analitik
Pada bagian sebelumnya, menyebutkan kelarutan yang luar biasa dari Agno dibuat3 Di dalam air. Ini menyiratkan bahwa ion ag+ Mereka akan larut tanpa masalah dan akan tersedia untuk berinteraksi dengan ion sedang berair, seperti anion halogenida (x = f-, Cl-, Br- dan saya-).
Perak seperti Ag+, Dan setelah penambahan HNO3 Diencerkan, mengendapkan fluorida, klorida, bromida dan iodida yang ada, yang terdiri dari padatan putih atau kekuningan:
Ag+(ac) +x-(AC) → AGX (S)
Teknik ini sangat berulang untuk mendapatkan halogenuros, dan juga digunakan dalam berbagai metode analitik kuantitatif.
Reagen Tollens
Agno3 Ini juga memainkan peran analitik dalam kimia organik, karena merupakan reagen utama, di sebelah amonia, untuk persiapan reagen Tollens. Reagen ini digunakan dalam uji kualitatif yang memungkinkan untuk menentukan keberadaan aldehida dan keton dalam sampel masalah.
Perpaduan
Agno3 Ini adalah sumber ion perak terlarut yang sangat baik. Ini, selain kerabat dan biaya rendah, menjadikannya reagen yang diminta untuk sintesis organik dan anorganik yang tak terhitung jumlahnya.
Itu dapat melayani Anda: Gibbs Free Energy: Unit, bagaimana itu dihitung, latihan terpecahkanApapun reaksinya, jika Anda membutuhkan ion Ag+, Jadi sangat mungkin bahwa bahan kimia menggunakan Agno3.
Obat
Agno3 Dia memiliki banyak popularitas dalam kedokteran sebelum penampilan antibiotik modern. Saat ini, bagaimanapun, masih digunakan untuk kasus tertentu, karena memiliki sifat caulster dan antibakteri.
Biasanya, dicampur dengan Kno3 Di ujung batang kayu, sehingga dicadangkan secara eksklusif untuk penggunaan topikal. Dalam hal ini, ia telah melayani untuk perawatan kutil, luka, kuku yang terinfeksi, ulkus mulut hidung dan pendarahan. Campuran agno3-Kno3 Cauteriza kulit menghancurkan jaringan dan bakteri yang rusak.
Aksi bakterisidal Agno3 Itu juga telah digunakan dalam pemurnian air.
Toksisitas dan efek samping
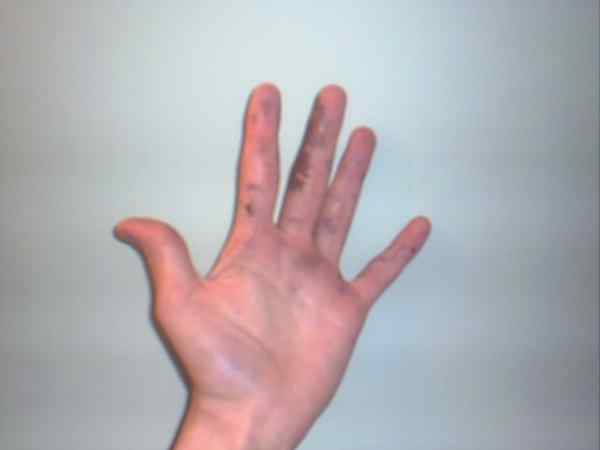 Nitrat perak dapat menyebabkan luka bakar yang ditampilkan oleh bintik -bintik ungu atau gelapnya. Sumber: Jane of Baden at English Wikipedia / Domain Publik
Nitrat perak dapat menyebabkan luka bakar yang ditampilkan oleh bintik -bintik ungu atau gelapnya. Sumber: Jane of Baden at English Wikipedia / Domain Publik Meskipun perak nitrat adalah gaji yang stabil dan tidak mewakili terlalu banyak risiko, itu adalah padatan yang sangat kaustik, yang konsumsi dapat menyebabkan kerusakan gastrointestinal parah.
Itu sebabnya manipulasi dengan sarung tangan direkomendasikan. Itu mungkin membakar kulit, dan dalam beberapa kasus, menggelapkannya sampai berubah menjadi ungu, kondisi atau penyakit yang dikenal sebagai Argiria.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Perak nitrat. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2020). Perak nitrat. Database pubchem., CID = 24470. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Elsevier b.V. (2020). Perak nitrat. Ilmiah. Diperoleh dari: Scientedirect.com
- Universitas Iowa. (2020). Penggunaan dan toksisitas nitrat perak. Pulih dari: obat.Uiowa.Edu
- P.F. Lindley & p. Ke arah hutan. (1966). Sebuah X-Penelitian Ray Nitrat Perak: Struktur Nitrat Logam Unik. Jurnal Masyarakat Kimia A: Anorganik, Fisik, Teoritis.
- Lucy Bell Young. (2020). Apa penggunaan medis nitrat perak. Bahan Kimia Reagen. Pulih dari: bahan kimia.bersama.Inggris
- « Struktur Piperidine, Sintesis, Derivatif, Reaksi
- Sejarah C ++, Karakteristik, Jenis Data, Contoh »

