Nomor massa apa yang terdiri dari dan bagaimana mendapatkannya (dengan contoh)
- 2659
- 458
- Leland Robel
Dia Nomor massa o Jumlah massa atom adalah jumlah dari jumlah proton dan jumlah nutron nukleus. Partikel -partikel ini ditunjuk secara bergantian dengan nama Nukleon, Oleh karena itu angka massa mewakili jumlahnya.
Biarkan N jumlah neutron hadir dan z jumlah proton, jika kita memanggil bagaimana nomor massa, lalu:
A = n + z
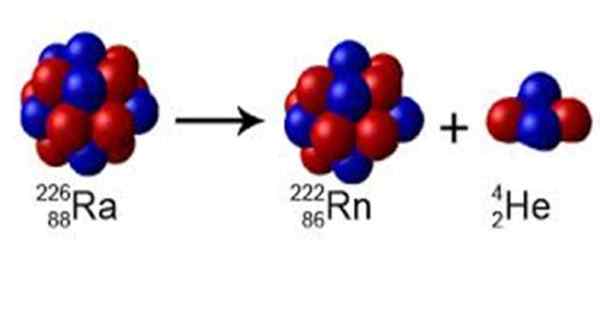
 Gambar 1. Radio memiliki angka massa A = 226, meluruh radon dengan A = 222 dan memancarkan inti helium A = 4. Sumber: Wikimedia Commons. Perox [CC0] [TOC]
Gambar 1. Radio memiliki angka massa A = 226, meluruh radon dengan A = 222 dan memancarkan inti helium A = 4. Sumber: Wikimedia Commons. Perox [CC0] [TOC]
Contoh angka massa
Segera beberapa contoh angka massa untuk elemen yang terkenal:
Hidrogen
Atom hidrogen yang paling stabil dan berlimpah juga merupakan yang paling sederhana: 1 proton dan elektron. Karena inti hidrogen tidak memiliki neutron, memang benar bahwa a = z = 1.
Oksigen
Inti oksigen memiliki 8 neutron dan 8 proton, oleh karena itu a = 16.
Karbon
Kehidupan di Bumi didasarkan pada kimia karbon, atom ringan dengan 6 proton dalam nukleus ditambah 6 neutron, sebagai a = 6 + 6 = 12.
Uranium
Elemen berat ini dari yang sebelumnya, terkenal dengan sifat radioaktifnya. Inti uranium memiliki 92 proton dan 146 neutron. Kemudian, nomor massa Anda adalah A = 92 + 146 = 238.
Bagaimana mendapatkan nomor massa?
Seperti yang dikatakan sebelumnya, angka massa A dari suatu elemen selalu sesuai dengan jumlah jumlah proton dan jumlah neutron yang mengandung nukleusnya. Ini juga merupakan bilangan bulat, tetapi ... apakah ada aturan dalam hal hubungan antara kedua kuantitas?
Mari kita lihat: semua elemen yang disebutkan di atas adalah ringan, kecuali uranium. Atom hidrogen, seperti yang kami katakan, paling sederhana. Ia tidak memiliki neutron, setidaknya dalam versi yang paling melimpah, dan dalam oksigen dan karbon, ada jumlah proton dan neutron yang sama.
Itu bisa melayani Anda: apa penghapusan emisinya? (Dengan contoh)Ini juga terjadi dengan elemen cahaya lainnya, seperti nitrogen, gas lain yang sangat penting untuk kehidupan, yang memiliki 7 proton dan 7 neutron. Namun, karena inti lebih kompleks dan atom menjadi lebih berat, jumlah neutron meningkat dengan ritme lain.
Tidak seperti elemen cahaya, uranium, dengan 92 proton, memiliki sekitar 1 ½ kali jumlah neutron: 1 ½ x 92 = 1.5 x 92 = 138.
Seperti yang Anda lihat, cukup dekat dengan 146, jumlah neutron yang dimilikinya.
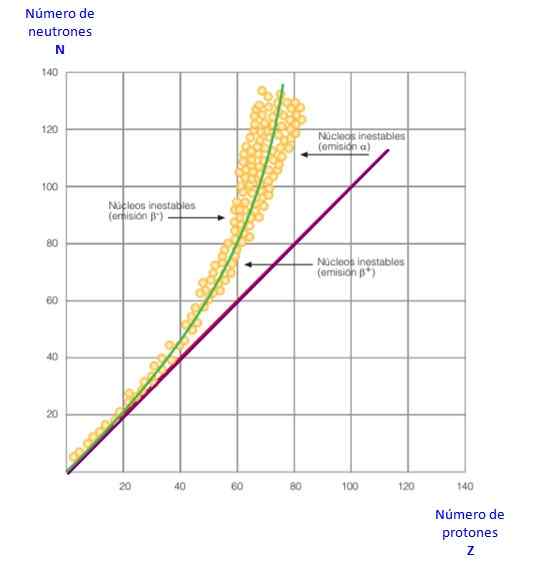 Gambar 2. Kurva stabilitas. Sumber: f. Zapata.
Gambar 2. Kurva stabilitas. Sumber: f. Zapata. Semua ini menjadi jelas dalam kurva Gambar 2. Itu adalah grafik n versus z, yang dikenal sebagai Kurva stabilitas nuklir. Di sana dapat dilihat bagaimana atom cahaya memiliki jumlah proton yang sama dengan neutron, dan bagaimana dari z = 20 jumlah neutron meningkat.
Dengan cara ini atom besar menjadi lebih stabil, karena kelebihan neutron mengurangi tolakan elektrostatik antara proton.
Notasi untuk atom
Notasi yang sangat berguna yang dengan cepat menggambarkan jenis atom adalah sebagai berikut: simbol elemen dan masing -masing nomor atom dan massa ditulis seperti yang ditunjukkan di bawah ini dalam skema ini:
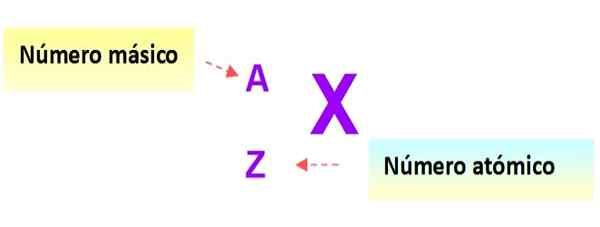 Gambar 3. Notasi atom. Sumber: f. Zapata.
Gambar 3. Notasi atom. Sumber: f. Zapata. Dalam notasi ini, atom dari contoh sebelumnya adalah:

Terkadang notasi lain yang lebih nyaman digunakan, di mana hanya simbol elemen dan nomor massa untuk menunjukkan atom yang digunakan, menghilangkan nomor atom. Dengan cara ini, 12 6C ditulis hanya sebagai karbon-12, 16 8Atau itu akan menjadi oksigen-16 dan untuk elemen apa pun.
Dapat melayani Anda: setengah lingkaran: cara menghitung perimeter, area, centroid, latihanIsotop
Jumlah proton dalam nukleus menentukan sifat elemen. Misalnya, setiap atom yang nukleusnya mengandung 29 proton adalah atom tembaga, apa pun yang terjadi.
Misalkan atom tembaga kehilangan elektron karena alasan apa pun, namun masih tembaga. Namun, sekarang ini adalah atom terionisasi.
Lebih sulit bagi inti atom untuk memenangkan atau kehilangan proton, tetapi di alam itu dapat terjadi. Misalnya di dalam bintang -bintang terus menerus terbentuk elemen yang lebih berat dari elemen cahaya, karena nukleus bintang berperilaku seperti reaktor fusi.
Dan di bumi ini ada fenomena dari disintegrasi radioaktif, di mana beberapa atom yang tidak stabil mengeluarkan nukleon dan memancarkan energi, berubah menjadi elemen lain.
Akhirnya ada kemungkinan bahwa atom elemen tertentu memiliki jumlah massa yang berbeda, dalam hal ini adalah a isotop.
Contoh yang baik adalah karbon-14 yang terkenal atau Radiokarbon, yang digunakan untuk tanggal objek arkeologis dan sebagai pelacak biokimia. Ini adalah karbon yang sama, dengan sifat kimia yang identik, tetapi dengan dua neutron tambahan.
Karbon-14 kurang berlimpah dari karbon-12, isotop stabil, dan juga radioaktif. Ini berarti bahwa seiring waktu meluruh dengan memancarkan energi dan partikel sampai menjadi elemen yang stabil, yang dalam kasusnya adalah nitrogen.
Isotop karbon
Karbon ada di alam sebagai campuran dari beberapa isotop, yang paling banyak adalah yang paling banyak 12 6C atau karbon-12. Dan selain karbon-14 adalah 13 6C dengan neutron tambahan.
Dapat melayani Anda: Sirkuit arus bergantian: jenis, aplikasi, contohIni umum di alam, misalnya timah, 10 isotop stabil diketahui. Di sisi lain, satu isotop dikenal sebagai berilium dan natrium.
Setiap isotop, alami atau buatan, memiliki ritme transformasi yang berbeda. Dengan cara yang sama dimungkinkan untuk membuat isotop buatan di laboratorium, yang biasanya tidak stabil dan membusuk secara radioaktif dalam periode fraksi kedua yang sangat singkat, sementara yang lain mengambil lebih banyak, sebanyak usia bumi atau lebih.
Tabel Isotop Karbon Alami
| Isotop karbon | Nomor atom z | Nomor massa a | Kelimpahan % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.sebelas |
| 14 6 C | 6 | 14 | Jejak |
Contoh terpecahkan
- Contoh 1
Apa perbedaan antara 13 7 N dan 14 7 N?
Menjawab
Keduanya adalah atom nitrogen, karena jumlah atomnya adalah 7. Namun, salah satu isotop, yang memiliki A = 13, memiliki neutron yang lebih sedikit, sedangkan 14 7 N adalah isotop yang paling berlimpah.
- Contoh 2
Berapa banyak neutron yang ada di dalam nukleus atom merkuri, ditunjukkan sebagai 201 80 HG?
Menjawab
Karena a = 201 dan z = 80, dan juga mengetahui hal itu:
A = z + n
N = a - z = 201 - 80 = 121
Dan disimpulkan bahwa atom merkuri memiliki 121 neutron.
Referensi
- Connor, n. Apa itu nukleon - struktur nukleus atom - definisi. Diperoleh dari: rabel berkala.org.
- Knight, r. 2017. Fisika untuk Ilmuwan dan Teknik: Pendekatan Strategi. Pearson.
- Sears, Zemansky. 2016. Fisika Universitas dengan Fisika Modern. 14. Ed. Volume 2.
- Tippens, hlm. 2011. Fisika: Konsep dan Aplikasi. Edisi ke -7. Bukit McGraw.
- Wikipedia. Nomor massa. Diperoleh dari: di.Wikipedia.org.
- « Magnesium nitrat (mg (no3) 2) struktur, sifat, penggunaan
- Coplanares Points Persamaan, contoh dan latihan terselesaikan »

