Struktur oksigen molekuler, sifat, penggunaan
- 1515
- 200
- Leland Robel
Dia Oksigen molekuler salah satu Dioxygen, Juga disebut oksigen diatomik atau gas, itu adalah bentuk dasar yang paling umum di mana elemen ini ditemukan di planet bumi. Formulanya adalah atau2, Oleh karena itu menjadi molekul diatomik dan homonuklear, benar -benar apolar.
Udara yang kami hirup terdiri dari sekitar 21% oksigen sebagai molekul atau2. Semakin banyak kita naik, konsentrasi oksigen gas menurun, dan meningkatkan keberadaan ozon, atau3. Tubuh kita memanfaatkan O2 Untuk mengoksidasi jaringan Anda dan melakukan pernapasan seluler.
 Tanpa oksigen yang memperkaya atmosfer kita, kehidupan akan menjadi fenomena yang tidak berkelanjutan. Sumber: Pixabay.
Tanpa oksigen yang memperkaya atmosfer kita, kehidupan akan menjadi fenomena yang tidak berkelanjutan. Sumber: Pixabay. O2 Dia juga bertanggung jawab atas keberadaan api: tanpa dia hampir mustahil untuk memiliki kebakaran dan pembakaran. Ini karena sifat utamanya adalah menjadi agen pengoksidasi yang kuat, memenangkan elektron atau mengurangi molekul air, atau dalam anion oksida, atau2-.
Oksigen molekuler sangat penting untuk proses aerobik yang tak terhitung jumlahnya, memiliki aplikasi dalam metalurgi, obat -obatan dan pengolahan air limbah. Gas ini secara praktis identik dengan panas, pernapasan, oksidasi dan, di sisi lain, suhu beku saat memiliki keadaan cairnya.
[TOC]
Struktur oksigen molekuler
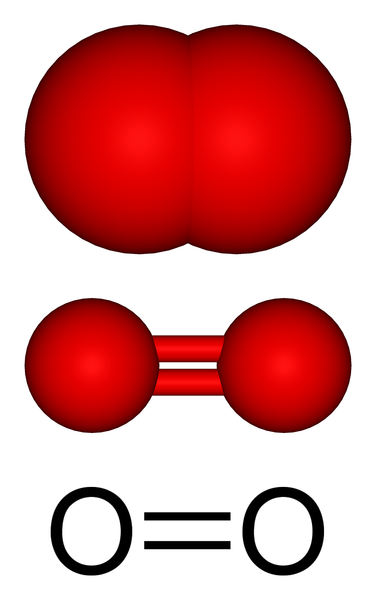
 Struktur molekul oksigen gas. Sumber: Benjah-BMM27 via Wikipedia.
Struktur molekul oksigen gas. Sumber: Benjah-BMM27 via Wikipedia. Pada gambar atas kita memiliki struktur molekul oksigen gas yang diwakili dengan beberapa model. Dalam dua yang terakhir, karakteristik ikatan kovalen yang membuat atom oksigen dibuktikan: ikatan rangkap O = O, di mana setiap atom oksigen menyelesaikan oktet Valencia -nya.
Dapat melayani Anda: diastreomerMolekul atau2 Itu linier, homonuklear dan simetris. Ikatan rangkapnya memiliki panjang 121 PM. Jarak pendek ini membuat energi tertentu yang diperlukan (498 kJ/mol) untuk memecahkan tautan O = O, dan oleh karena itu merupakan molekul yang relatif stabil.
Jika demikian, oksigen atmosfer akan benar -benar terdegradasi dari waktu ke waktu, atau udara tidak akan terbakar pada apa pun.
Properti
Penampilan fisik
Oksigen molekuler adalah gas yang tidak berwarna, tidak berasa dan tidak berbau, tetapi saat kondensasi dan mengkristal memperoleh nada kebiruan.
Masa molar
32 g/mol (nilai bulat)
Titik lebur
-218 ºC
Titik didih
-183
Kelarutan
Oksigen molekuler tidak terlalu larut dalam air, tetapi cukup untuk mendukung fauna laut. Jika kelarutan Anda lebih besar, akan lebih kecil kemungkinannya untuk mati karena tenggelam. Di sisi lain, kelarutannya jauh lebih besar dalam minyak dan cairan apolar, mampu mengoksidasi mereka secara perlahan dan dengan demikian mempengaruhi sifat aslinya.
Status energi
Oksigen molekuler adalah zat yang tidak dapat sepenuhnya dijelaskan oleh Valencia Link Theory (TEV).
Konfigurasi oksigen elektronik adalah sebagai berikut:
[Dia] 2s² 2p⁴
Itu memiliki sepasang elektron yang hilang (atau :). Ketika dua atom oksigen ditemukan, mereka terkait untuk membentuk ikatan rangkap O = O, menyelesaikan kedua oktet Valencia.
Oleh karena itu, molekul atau2 Itu harus diamagnetik, dengan semua elektron berpasangan. Namun, ini adalah molekul paramagnetik, dan ini dijelaskan oleh diagram orbital molekulnya:
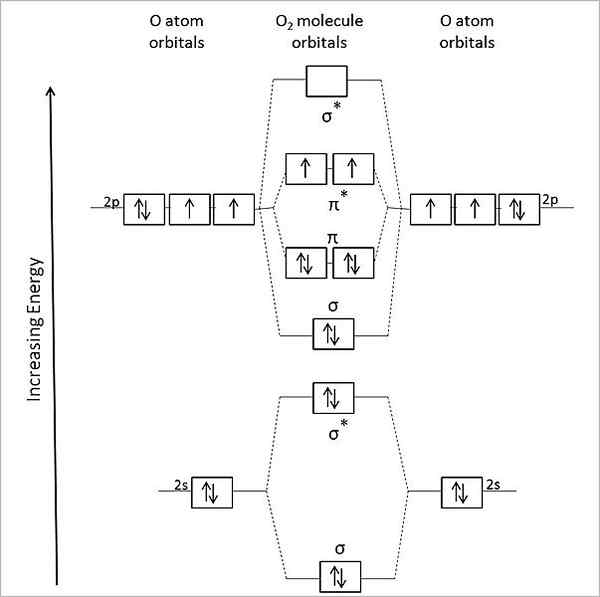 Diagram orbital molekul untuk oksigen gas. Sumber: Anthony.Sebastian/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/3.0)
Diagram orbital molekul untuk oksigen gas. Sumber: Anthony.Sebastian/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/3.0) Dengan demikian, teori orbital molekul (TOM) lebih baik menggambarkan OR2. Dua elektron yang hilang terletak di orbital molekul π*, energi yang lebih besar, dan berikan oksigen dengan karakter paramagnetiknya.
Dapat melayani Anda: methylamine: struktur, sifat, produksi, penggunaanFaktanya, keadaan energi ini sesuai dengan oksigen triplet, 3SALAH SATU2, Yang paling dominan dari semuanya. Keadaan energi oksigen lainnya, kurang berlimpah di bumi, adalah lajang, 1SALAH SATU2.
Transformasi
Oksigen molekuler sangat stabil selama tidak bersentuhan dengan zat apa pun yang rentan terhadap pengoksidasi, apalagi jika tidak ada sumber panas yang kuat, seperti percikan. Ini karena o2 Ini memiliki kecenderungan tinggi untuk mengurangi, mendapatkan elektron dari atom atau molekul lain.
Saat dikurangi, ia dapat membangun spektrum tautan dan bentuk yang luas. Jika membentuk ikatan kovalen, itu akan melakukannya dengan atom elektronegatif yang lebih sedikit darinya, termasuk hidrogen, untuk berasal air, h-o-h. Ini juga dapat berupa alam semesta karbon, menyebabkan ikatan C-O dan beberapa jenis molekul organik teroksigenasi (Éteres, keton, aldehida, dll.).
O2 Anda juga bisa mendapatkan elektron untuk mengubah peroksida dan superoksida, atau22- SAYA2-, masing -masing. Ketika menjadi peroksida dalam organisme, hidrogen peroksida diperoleh, h2SALAH SATU2, H-O-O-H, senyawa berbahaya yang diproses oleh aksi enzim spesifik (peroksidase dan katalas).
Di sisi lain, dan paling tidak, o2 bereaksi dengan materi anorganik menjadi anion oksida, atau2-, menyusun daftar massa mineralogi yang tak ada habisnya yang membengkak kulit dan mantel darat.
Aplikasi
Lasan dan pembakaran
 Oksigen digunakan untuk pembakaran asetilena dan menembakkan nyala api yang intens yang berharga dalam lasan. Sumber: sheila/cc by (https: // createveCommons.Org/lisensi/oleh/2.0)
Oksigen digunakan untuk pembakaran asetilena dan menembakkan nyala api yang intens yang berharga dalam lasan. Sumber: sheila/cc by (https: // createveCommons.Org/lisensi/oleh/2.0) Oksigen digunakan untuk melakukan reaksi pembakaran, yang dengannya suatu zat secara eksotermis mengeluarkan api. Api ini dan suhunya bervariasi tergantung pada zat yang terbakar. Dengan demikian, api yang sangat panas dapat diperoleh, seperti asetilena (di atas), dengan logam dan paduan yang dilas.
Dapat melayani Anda: entalpiJika bukan karena oksigen, bahan bakar tidak dapat membakar dan menyediakan semua energi kalori mereka, digunakan untuk melepas roket, atau untuk memulai mobil.
Zat oksidan dalam kimia hijau
Berkat gas ini, oksida organik dan anorganik yang tak ada habisnya disintesis atau diproduksi secara industri. Reaksi ini didasarkan pada kekuatan pengoksidasi oksigen molekuler, menjadi salah satu reagen kimia hijau yang paling layak untuk mendapatkan produk farmasi.
Pernapasan dan pengolahan air limbah yang dibantu
Oksigen sangat penting untuk memenuhi permintaan pernapasan pada pasien dengan keadaan kesehatan yang serius, di penyelam ketika mereka turun di kedalaman rendah, dan di pendaki gunung, di mana ketinggian konsentrasi oksigen terlihat berkurang secara dramatis berkurang secara dramatis.
Demikian juga, oksigen "memberi makan" bakteri aerobik, yang membantu menurunkan limbah yang terkontaminasi dari air limbah, atau membantu menghirup ikan, dalam tanaman berair untuk perlindungan atau perdagangan.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Alotrop oksigen. Diperoleh dari: di.Wikipedia.org
- Mengasah, c.KE., Kappe, c.SALAH SATU. (2019). Penggunaan oksigen molekuler untuk oksidasi aerobik fase cair dalam aliran kontinu. Top Curr Chem (Z)377, 2. doi.org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28 Januari 2020). 10 Penggunaan untuk Oksigen. Pulih dari: ilmuwan.com
- Cliffsnotes. (2020). Biokimia I: Kimia oksigen molekuler. Pulih dari: Cliffsnotes.com
- Persediaan Industri GZ. (2020). Manfaat Industri Gas Oksigen. Diperoleh dari: GZ-Supplies.com
- « Budaya Tradisi Portugal, Kebiasaan, Gastronomi, Agama
- Formula dan persamaan interferensi yang merusak, contoh, olahraga »

