Sifat oksigen, struktur, risiko, penggunaan

- 2781
- 495
- Herbert Fritsch
Dia oksigen Itu adalah elemen kimia yang diwakili oleh simbol atau. Ini adalah gas yang sangat reaktif, yang mengepalai kelompok 16: calcogens. Nama ini karena sulfur dan oksigen hadir di hampir semua mineral.
Elektronegativitasnya yang tinggi menjelaskan aviditasnya yang besar oleh elektron, yang mengarah pada bergabung dengan sejumlah besar elemen; Beginilah berbagai macam oksida mineral yang muncul yang memperkaya kerak bumi. Dengan demikian, oksigen yang tersisa menyusun dan membuat atmosfer bisa bernapas.
 Oksigen biasanya identik dengan udara dan air, tetapi juga ditemukan di batu dan mineral. Sumber: Pxhere.
Oksigen biasanya identik dengan udara dan air, tetapi juga ditemukan di batu dan mineral. Sumber: Pxhere. Oksigen adalah elemen ketiga dalam kelimpahan di alam semesta, di belakang hidrogen dan helium, dan juga merupakan konstituen massa utama dari korteks bumi. Ini memiliki persentase volume 20,8% dari atmosfer bumi, dan mewakili 89% dari massa air.
Biasanya memiliki dua bentuk alotropik: oksigen diatomik (atau2), yang merupakan cara paling sering di alam, dan ozon (atau3), ditemukan di stratosfer. Namun, ada dua lainnya (atau4 SAYA8) Itu ada dalam fase cair atau padat, dan di bawah tekanan besar.
Oksigen terus diproduksi melalui proses fotosintesis, dilakukan oleh fitoplankton dan tanaman terestrial. Setelah diproduksi, itu dilepaskan sehingga makhluk hidup dapat menggunakannya, sementara sebagian kecil dari itu larut di laut, mendukung kehidupan air.
Karena itu merupakan elemen penting bagi makhluk hidup; Bukan hanya karena ada di sebagian besar senyawa dan molekul yang membentuknya, tetapi juga campur tangan dalam semua proses metabolisme mereka.
Meskipun secara kontroversial isolasinya disebabkan oleh Carl Scheele dan Joseph Priestley pada 1774, ada indikasi bahwa oksigen sebenarnya diisolasi untuk pertama kalinya pada 1608, oleh Michael Sendivogius.
Gas ini digunakan dalam praktik medis untuk meningkatkan kondisi kehidupan pasien dengan kesulitan pernapasan. Demikian juga, oksigen digunakan untuk memungkinkan orang memenuhi fungsinya di lingkungan di mana ada penurunan atau tidak ada akses ke oksigen atmosfer.
Oksigen yang diproduksi secara komersial terutama digunakan dalam industri metalurgi untuk konversi besi menjadi baja.
[TOC]
Sejarah
Semangat nitroaria
Pada 1500, Leonardo da Vinci, berdasarkan eksperimen Philo de Byzantium yang diadakan pada abad kedua hingga. C., Dia menyimpulkan bahwa sebagian udara dikonsumsi selama pembakaran dan bernafas.
Pada 1608, Cornelius Drebble menunjukkan bahwa ruang pemanas (perak nitrat, kno3) Gas terjadi. Gas ini, seperti yang akan diketahui nanti, adalah oksigen; Tapi DREBBLE tidak bisa mengidentifikasinya sebagai elemen baru.
Kemudian, pada tahun 1668, John Majow menunjukkan bahwa sebagian udara yang ia sebut "Spiritus nitroaerus" bertanggung jawab atas kebakaran, dan bahwa itu juga dikonsumsi selama bernafas dan pembakaran zat. Majow mengamati bahwa zat tidak mengatur tanpa adanya semangat nitroaria.
Majoow melakukan pembakaran antimon, dan mengamati peningkatan berat antimon selama pembakarannya. Kemudian, Majow menyimpulkan bahwa antimon dikombinasikan dengan semangat nitroaria.
Penemuan
Meskipun ia tidak menerima pengakuan dari komunitas ilmiah, dalam kehidupan atau setelah kematiannya, Michael Sandivogius (1604) cenderung menjadi penemu oksigen sejati.
Sandivogius adalah seorang alkemis, filsuf dan dokter Swedia yang menghasilkan dekomposisi termal kalium nitrat. Eksperimennya membawanya ke pelepasan oksigen, yang disebutnya "Cibus Vitae": Food of Life.
Antara 1771 dan 1772, ahli kimia Swedia Carl W Scheele menghangatkan beberapa senyawa: kalium nitrat, mangan oksida dan merkuri oksida. Scheele mengamati bahwa gas yang meningkatkan pembakaran dilepaskan dari mereka, dan yang disebutnya "udara api".
Eksperimen Joseph Priestly
Pada 1774, ahli kimia Inggris Joseph Priestly menghangatkan merkuri oksida dengan menggunakan lensa peningkatan dua belas inci yang memusatkan sinar matahari. Merkuri oksida melepaskan gas yang menyebabkan lilin terbakar lebih cepat dari biasanya.
Selain itu, imamat menguji efek biologis gas. Untuk melakukan ini, ia menempatkan dalam wadah tertutup tikus yang ia harapkan akan bertahan hidup lima belas menit; Namun, di hadapan gas dia bertahan satu jam, lebih dari yang dia perkirakan.
Priestly menerbitkan hasilnya pada tahun 1774; Saat Scheele melakukannya pada 1775. Untuk alasan ini, penemuan oksigen ke imam biasanya dikaitkan.
Oksigen di udara
Antoine Lavoisier, seorang ahli kimia Prancis (1777), menemukan bahwa udara mengandung 20% oksigen dan bahwa ketika suatu zat terbakar, sebenarnya dikombinasikan dengan oksigen.
Lavoisier menyimpulkan bahwa penambahan berat badan yang jelas dialami zat selama pembakaran adalah karena penurunan berat badan yang terjadi di udara; Karena oksigen dikombinasikan dengan zat -zat ini dan, oleh karena itu, massa reaktan dipertahankan.
Ini memungkinkan Lavoisier untuk menetapkan hukum konservasi materi. Lavoisier menyarankan nama oksigen yang berasal dari akar asam "oxys" dan "gen" pembentukan. Maka oksigen berarti 'asam mantan'.
Nama ini salah, karena tidak semua asam mengandung oksigen; Misalnya, hidrogen halogenida (HF, HCl, HBR dan HI).
Dalton (1810) ditugaskan ke air formula kimia dan oleh karena itu, berat atom oksigen adalah 8. Sekelompok bahan kimia, termasuk: Davy (1812) dan Berzelius (1814) mengoreksi pendekatan Dalton dan menyimpulkan bahwa formula air yang benar adalah H2O dan berat atom oksigen adalah 16.
Dapat melayani Anda: Air DisionisasiSifat fisik dan kimia
Penampilan
Tidak berwarna, toilet, dan gas hambar; Sementara ozon memiliki bau acre. Oksigen mendukung pembakaran, tetapi dengan sendirinya bukan bahan bakar.
 Oksigen cair. Sumber: Staf Sersan. Nika Glover, u.S. Angkatan Udara [Domain Publik]
Oksigen cair. Sumber: Staf Sersan. Nika Glover, u.S. Angkatan Udara [Domain Publik] Dalam bentuk cairnya (gambar atas) berwarna biru pucat, dan kristal -kristalnya juga kebiruan; Tetapi mereka dapat memperoleh nada merah muda, oranye, dan bahkan kemerahan (seperti yang akan dijelaskan di bagian strukturnya).
Berat atom
15.999 u.
Nomor Atom (Z)
8.
Titik lebur
-218.79 ºC.
Titik didih
-182.962 ºC.
Kepadatan
Dalam kondisi normal: 1.429 g/l. Oksigen adalah gas terpadat dari udara. Selain itu, ini adalah konduktor panas dan listrik yang buruk. Dan pada titik didihnya (cairan), kepadatannya adalah 1.141 g/ml.
Tiga poin
54.361 K dan 0,1463 kPa (14,44 ATM).
Titik kritis
154.581 K dan 5.043 MPa (49770.54 ATM).
Panas fusi
0,444 kJ/mol.
Panas penguapan
6,82 kJ/mol.
Kapasitas kalori molar
29.378 J/(mol · k).
Tekanan uap
Pada suhu 90 K memiliki tekanan uap 986,92 atm.
Keadaan oksidasi
-2, -1, +1, +2. Status oksidasi terpenting adalah -2 (atau2-).
Elektronegativitas
3.44 pada skala Pauling
Energi ionisasi
Pertama: 1.313.9 kJ/mol.
Kedua: 3.388.3 kJ/mol.
Ketiga: 5.300,5 kJ/mol.
Urutan magnetik
Paramagnetik.
Kelarutan air
Kelarutan oksigen dalam air berkurang seiring dengan meningkatnya suhu. Misalnya: 14,6 mL oksigen/L air dilarutkan pada 0 ºC dan 7,6 mL oksigen/L air pada 20 ºC. Kelarutan oksigen dalam air minum lebih besar dari pada air laut.
Dalam kondisi suhu 25 ºC dan pada tekanan 101,3 kPa, air minum dapat mengandung 6,04 mL oksigen/L air; Sedangkan air air laut hanya 4,95 ml oksigen/L air.
Reaktivitas
Oksigen adalah gas yang sangat reaktif yang bereaksi langsung dengan hampir semua elemen pada suhu kamar dan suhu tinggi; kecuali logam dengan potensi pengurangan yang lebih tinggi dari tembaga.
Anda juga dapat bereaksi dengan senyawa, mengoksidasi elemen yang ada di dalamnya. Inilah yang terjadi ketika bereaksi dengan glukosa, misalnya, untuk menghasilkan air dan karbon dioksida; atau saat kayu atau hidrokarbon terbakar.
Oksigen dapat menerima elektron dengan transfer lengkap atau parsial, sehingga dianggap sebagai zat pengoksidasi.
Jumlah oksidasi atau status oksidasi yang paling umum adalah -2. Dengan angka oksidasi ini ditemukan di dalam air (h2O), sulfur dioksida (jadi2) dan karbon dioksida (CO2).
Juga, dalam senyawa organik seperti aldehida, alkohol, asam karboksilat; Asam umum seperti h2Sw4, H2BERSAMA3, Hno3; dan dalam garam yang diturunkan: na2Sw4, Na2BERSAMA3 OK tidak3. Dalam semua itu, keberadaan O dapat diasumsikan2- (yang tidak berlaku untuk senyawa organik).
Oksida
Oksigen hadir sebagai atau2- Dalam struktur kristal oksida logam.
Di sisi lain, dalam superoksida logam, seperti kalium superoksida (KO2), oksigen seperti ion atau2-. Saat berada di peroksida logam, untuk mengatakan barium peroksida (BAO2), oksigen disajikan sebagai ion atau22- (BA2+SALAH SATU22-).
Isotop
Oksigen memiliki tiga isotop stabil: 16Atau, dengan kelimpahan 99,76%; Dia 17Atau, dengan 0,04%; dan 18Atau, dengan 0,20%. Perhatikan bahwa dia 16Atau sejauh ini isotop yang paling stabil dan berlimpah.
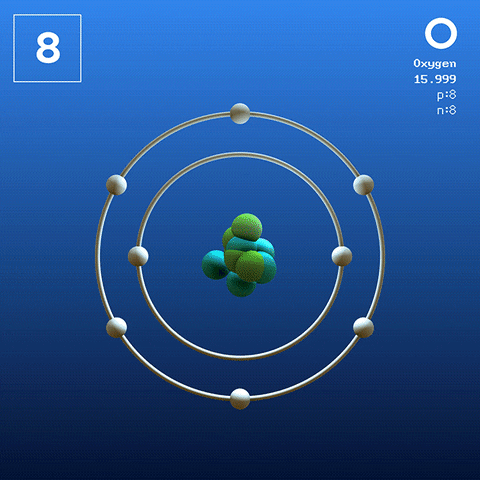
Struktur dan konfigurasi elektronik
Molekul dan interaksi oksigen
 Molekul oksigen diatomik. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Molekul oksigen diatomik. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Oksigen dalam keadaan basal adalah atom yang konfigurasi elektroniknya adalah:
[Dia] 2s2 2 p4
Menurut Valencia Link Theory (TEV), dua atom oksigen terkait secara kovalen sehingga keduanya secara terpisah menyelesaikan oktet Valencia mereka; Selain bisa kawin dengan dua elektron kesepian mereka dari orbital 2p.
Dengan cara ini, molekul diatomik oksigen muncul, atau2 (Gambar yang lebih tinggi), yang memiliki ikatan rangkap (O = O). Stabilitas energinya sedemikian rupa sehingga oksigen tidak pernah ditemukan sebagai atom individu dalam fase gas tetapi sebagai molekul.
Karena o2 Dia homonuklear, linier dan simetris, tidak memiliki momen dipol permanen; Oleh karena itu, interaksi antarmolekulnya tergantung pada massa molekulnya dan kekuatan dispersi London. Kekuatan -kekuatan ini relatif lemah untuk oksigen, yang menjelaskan mengapa itu adalah gas dalam kondisi terestrial.
Namun, ketika suhu turun atau meningkatkan tekanan, molekul atau2 Mereka dipaksa untuk kohesif; sampai -sampai interaksi mereka menjadi signifikan dan memungkinkan pembentukan oksigen cair atau padat. Untuk mencoba memahaminya secara molekuler, perlu untuk tidak melupakan O2 sebagai unit struktural.
Ozon
Oksigen dapat mengadopsi struktur molekul lainnya yang sangat stabil; Yaitu, ditemukan di alam (atau di dalam laboratorium) dalam berbagai bentuk alotropik. Ozon (gambar bawah), atau3, Misalnya, ini adalah alotrop kedua dari oksigen yang paling terkenal.
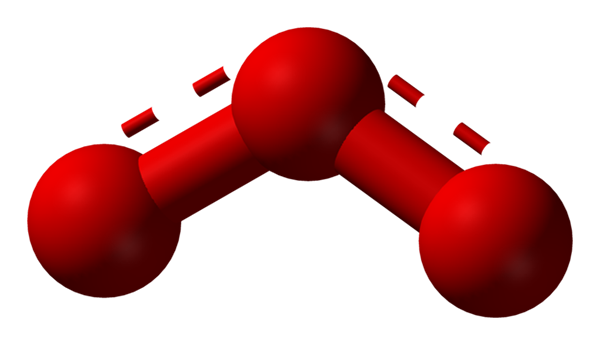 Struktur hibrida resonansi yang diwakili oleh model bola dan batang untuk molekul ozon. Sumber: Ben Mills via Wikipedia.
Struktur hibrida resonansi yang diwakili oleh model bola dan batang untuk molekul ozon. Sumber: Ben Mills via Wikipedia. Sekali lagi, TEV memegang, menjelaskan dan menunjukkan bahwa di OR3 Harus ada struktur resonansi yang menstabilkan beban formal positif oksigen tengah (garis yang dihiasi merah); Saat oksigen dari akhir bumerang, beban negatif didistribusikan, menyebabkan total beban untuk ozon.
Dapat melayani Anda: Peraturan Kelarutan: Aspek dan Aturan UmumDengan cara ini, tautannya tidak sederhana, tetapi tidak ganda. Contoh hibrida resonansi sangat umum pada banyak molekul atau ion anorganik.
O2 SAYA3, Akibatnya struktur molekulnya berbeda, hal yang sama berlaku untuk sifat fisik dan kimianya, fase cair atau kristal (bahkan jika keduanya mengkonsumsi atom oksigen). Mereka berteori bahwa sintesis pada skala besar ozon siklik kemungkinan, yang strukturnya menyerupai segitiga kemerahan dan teroksigenasi.
Sejauh ini "alotrop normal" oksigen tiba. Namun, ada dua orang lain yang perlu dipertimbangkan: o4 SAYA8, Ditemukan atau diusulkan dalam oksigen cair dan padat, masing -masing.
Oksigen cair
Oksigen gas tidak berwarna, tetapi ketika suhu turun ke -183 ºC, mengembun dalam cairan biru pucat (Celestial serupa). Interaksi antara molekul atau2 Sekarang bahkan elektron mereka dapat menyerap foton di daerah merah dari spektrum yang terlihat untuk mencerminkan warna biru khasnya.
Namun, telah berteori bahwa dalam cairan ini ada lebih dari molekul sederhana atau2, tetapi juga molekul atau4 (gambar bawah). Sepertinya ozon telah "macet" atom oksigen lain yang entah bagaimana menengahi oleh beban formal formal yang baru dijelaskan.
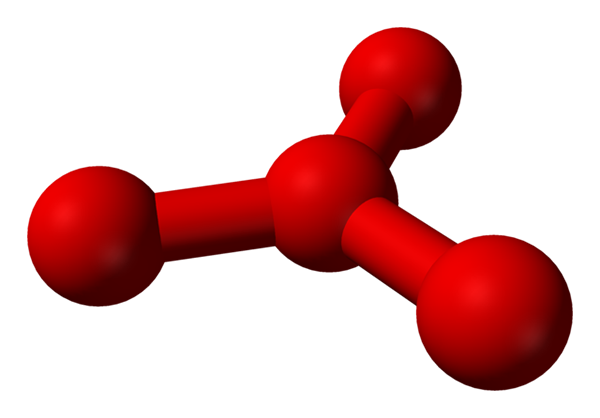 Model yang diusulkan struktur dengan bola dan batang untuk molekul tetraoksigen. Sumber: Benjah-BMM27 [Domain Publik]
Model yang diusulkan struktur dengan bola dan batang untuk molekul tetraoksigen. Sumber: Benjah-BMM27 [Domain Publik] Masalahnya adalah bahwa menurut komputer dan simulasi molekuler, struktur untuk O4 Itu tidak stabil; Namun, mereka memperkirakan bahwa mereka memang ada sebagai unit (atau2)2, yaitu dua molekul O2 Mereka sangat mendekati sehingga mereka membentuk semacam kerangka yang tidak teratur (atom atau tidak selaras satu sama lain).
Oksigen padat
Setelah suhu turun ke -218,79 ºC, oksigen mengkristal dalam struktur kubik sederhana (fase γ). Ketika suhu turun lebih banyak lagi, kaca kubik menderita transisi ke fase β (rhomboédica dan pada -229,35 ºC) dan α (monoklinik dan pada -249,35 ºC).
Semua fase kristal oksigen padat ini terjadi pada tekanan sekitar (1 atm). Saat tekanan meningkat menjadi 9 GPa (~ 9000 atm), fase Δ muncul, yang kristalnya oranye. Jika tekanan terus meningkat menjadi 10 GPa, oksigen padat merah muncul atau fase ε (sekali lagi monoklinik).
Fase ε adalah khusus karena tekanannya sangat besar sehingga molekul atau2 Mereka tidak hanya ditampung sebagai unit atau4, tetapi juga atau8:
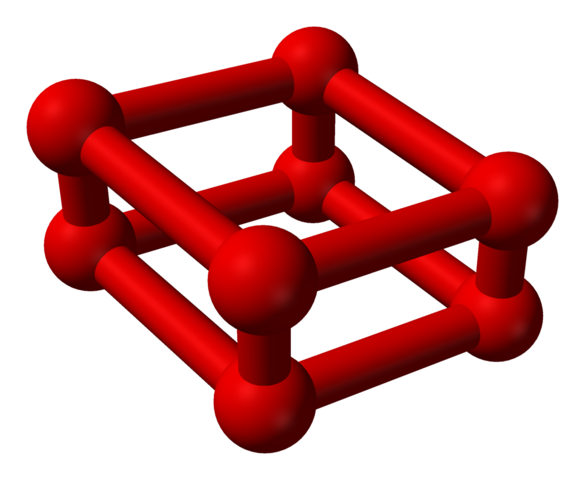 Struktur model dengan bola dan batang untuk molekul octaoxygen. Sumber: Benjah-BMM27 [Domain Publik]
Struktur model dengan bola dan batang untuk molekul octaoxygen. Sumber: Benjah-BMM27 [Domain Publik] Perhatikan bahwa ini atau8 Itu terdiri dari dua unit atau4 di mana kerangka kerja tidak teratur sudah dijelaskan. Juga berlaku untuk menganggapnya sebagai empat atau2 Sejalan erat dan dalam posisi vertikal. Namun, stabilitasnya berada di bawah tekanan ini sehingga OR4 SAYA8 Mereka adalah dua alotrop tambahan untuk oksigen.
Dan akhirnya kita memiliki fase ζ, logam (untuk tekanan yang lebih besar dari 96 GPa), di mana tekanan membuat elektron tersebar di kaca; Seperti halnya logam.
Dimana dan produksi
Mineral
Oksigen dalam massa elemen ketiga alam semesta, di belakang hidrogen dan helium. Itu merupakan elemen paling berlimpah dari kerak bumi, mewakili sekitar 50% dari massanya. Ini terutama dikombinasikan dengan silikon, dalam bentuk silikon oksida (sio2).
Oksigen menjadi bagian dari mineral yang tak terhitung banyaknya. Demikian juga, terletak sebagai bagian dari banyak senyawa seperti karbonat, fosfat, sulfat, nitrat, dll.
Udara
Oksigen merupakan 20,8% dari udara atmosfer dalam volume. Di troposfer itu terutama seperti molekul oksigen diatomik. Saat berada di stratosfer, lapisan gas antara 15 dan 50 km permukaan bumi, seperti ozon.
Ozon diproduksi oleh sengatan listrik pada molekul O2. Alotrop oksigen ini menyerap cahaya ultraviolet radiasi matahari, menghalangi aksinya yang berbahaya pada manusia, yang dalam kasus ekstrem dikaitkan dengan penampilan melanoma.
Air segar dan asin
Oksigen adalah komponen utama air laut dan air tawar dari danau, sungai dan air tanah. Oksigen adalah bagian dari formula kimia air, massa 89% darinya.
Di sisi lain, meskipun kelarutan oksigen dalam air relatif rendah, jumlah oksigen yang dilarutkan dalam hal ini sangat penting untuk kehidupan akuatik, yang mencakup banyak spesies hewan dan ganggang.
Makhluk hidup
Manusia terbentuk, sekitar 60% air dan pada saat yang sama, kaya oksigen. Tetapi di samping itu, oksigen adalah bagian dari banyak senyawa, seperti fosfat, karbonat, asam karboksilat, keton, dll., yang penting untuk hidup.
Oksigen juga hadir dalam polisakarida, lipid, protein dan asam nukleat; yaitu, makromolekul biologis yang disebut begitu.
Ini juga merupakan bagian dari limbah berbahaya aktivitas manusia, misalnya: karbon dioksida dan dioksida, serta sulfur dioksida.
Produksi biologis
 Tanaman bertanggung jawab untuk memperkaya udara oksigen dengan imbalan karbon dioksida yang kita napas. Sumber: Pexels.
Tanaman bertanggung jawab untuk memperkaya udara oksigen dengan imbalan karbon dioksida yang kita napas. Sumber: Pexels. Oksigen terjadi selama fotosintesis, suatu proses di mana fitoplankton laut dan tanaman terestrial menggunakan energi cahaya untuk bereaksi karbon dioksida dengan air, menyebabkan glukosa dan melepaskan oksigen.
Diperkirakan bahwa lebih dari 55% oksigen yang diproduksi oleh fotosintesis disebabkan oleh aksi fitoplankton laut. Oleh karena itu, ini merupakan sumber utama generasi oksigen di bumi dan bertanggung jawab atas pemeliharaan kehidupan di dalamnya.
Produksi industri
Pencairan udara
Metode produksi oksigen industri utama dibuat pada tahun 1895, secara independen oleh Karl Paul Gottfried von Linde dan William Hamson. Metode ini saat ini menggunakan beberapa modifikasi.
Dapat melayani Anda: butanone: struktur, sifat dan penggunaanProses dimulai dengan kompresi udara untuk memadatkan uap air dan dengan demikian menghilangkannya. Kemudian, udara diayak ketika dilakukan dengan campuran zeolit dan gel silika, untuk penghapusan karbon dioksida, hidrokarbon berat dan sisa air.
Selanjutnya, komponen udara cair dipisahkan melalui distilasi fraksional, mencapai pemisahan gas yang ada di titik didihnya yang berbeda. Dengan metode ini oksigen diperoleh dengan kemurnian 99%.
Elektrolisis air
Oksigen diproduksi oleh elektrolisis air yang sangat murni, dan dengan konduktivitas listrik yang tidak melebihi 1 μs/cm. Air dipisahkan oleh elektrolisis dalam komponennya. Hidrogen saat kation bergerak ke katoda (-); Sementara oksigen bergerak ke arah anoda (+).
Elektroda memiliki struktur khusus untuk mengumpulkan gas dan selanjutnya menghasilkan pencairannya.
Dekomposisi termal
Dekomposisi termal senyawa seperti merkuri oksida dan inang (kalium nitrat), melepaskan oksigen, yang dapat dikumpulkan untuk digunakan. Peroksida juga digunakan untuk tujuan ini.
Kertas Biologis
Oksigen diproduksi oleh fitoplankton dan tanaman darat melalui fotosintesis. Ini melintasi dinding paru dan dalam darah ditangkap oleh hemoglobin, yang mengangkutnya ke organ yang berbeda dan kemudian digunakan dalam metabolisme sel.
Dalam proses ini oksigen digunakan selama metabolisme karbohidrat, asam lemak dan asam amino, untuk akhirnya menghasilkan karbon dioksida dan energi.
Pernapasan dapat ditentukan sebagai berikut:
C6H12SALAH SATU6 + SALAH SATU2 => Co2 + H2Atau +energi
Glukosa dimetabolisme dalam serangkaian proses kimia berurutan, yang meliputi glikolisis, siklus Krebs, rantai transpor elektronik dan fosforilasi oksidatif. Rangkaian peristiwa ini menghasilkan energi yang menumpuk sebagai ATP (Adenosín Triposphate).
ATP digunakan dalam berbagai proses dalam sel yang mencakup pengangkutan ion dan zat lain melalui membran plasma; penyerapan zat usus; kontraksi sel otot yang berbeda; Metabolisme molekul yang berbeda, dll.
Leukosit polimorfonuklear dan makrofag adalah sel fagositik yang mampu menggunakan oksigen untuk menghasilkan ion superoksida, hidrogen peroksida dan oksigen tunggal, yang digunakan untuk menghancurkan mikroorganisme.
Risiko
Menghirup oksigen ke tekanan tinggi dapat menyebabkan mual, pusing, kejang otot, kehilangan penglihatan, kejang dan kehilangan kesadaran. Selain itu, menghirup oksigen murni untuk jangka waktu yang lama menyebabkan iritasi paru, dimanifestasikan oleh batuk dan pemendekan pernapasan.
Ini juga bisa menjadi penyebab pembentukan edema paru: kondisi yang sangat serius yang membatasi fungsi pernapasan.
Suasana dengan konsentrasi oksigen tinggi bisa berbahaya, karena memfasilitasi pengembangan kebakaran dan ledakan.
Aplikasi
Dokter
Oksigen diberikan kepada pasien yang mengalami kegagalan pernapasan; Begitulah kasus pasien yang terkena pneumonia, edema paru atau emfisema. Mereka tidak bisa menghirup oksigen lingkungan karena mereka akan terpengaruh secara serius.
Pasien dengan gagal jantung dalam apa yang disajikan akumulasi cair pada alveoli juga membutuhkan oksigen untuk disediakan; Seperti pasien yang menderita kecelakaan vaskular parah (stroke).
Kebutuhan pekerjaan
Petugas pemadam kebakaran yang memadamkan api di lingkungan dengan ventilasi yang tidak pantas, membutuhkan penggunaan topeng dan botol oksigen yang memungkinkan mereka untuk memenuhi fungsi mereka, tanpa menempatkan hidup mereka dalam risiko yang lebih besar.
Kapal selam dilengkapi dengan peralatan produksi oksigen yang memungkinkan para pelaut untuk tetap berada di lingkungan tertutup tanpa akses udara atmosfer.
Penyelam melakukan pekerjaan mereka terendam di dalam air dan, oleh karena itu, terisolasi dari udara atmosfer. Mereka bernafas dengan oksigen yang dipompa oleh tabung yang terhubung dengan pemindaian mereka atau penggunaan bombon yang melekat pada tubuh kapal selam.
Astronot melakukan aktivitas mereka di lingkungan yang dilengkapi dengan generator oksigen yang memungkinkan bertahan hidup selama perjalanan ruang angkasa dan di stasiun ruang angkasa.
Industri
Lebih dari 50% oksigen yang diproduksi secara industri dikonsumsi dalam transformasi besi menjadi baja. Besi cor disuntikkan dengan jet oksigen untuk menghilangkan sulfur dan karbon yang ada; bereaksi terhadap menghasilkan gas2 dan co2, masing -masing.
Asetilena digunakan dalam kombinasi dengan oksigen untuk memotong pelat logam dan juga menghasilkan pengelasannya. Oksigen juga digunakan dalam produksi gelas, meningkatkan pembakaran dalam memanggangnya untuk meningkatkan transparansi.
Spektrofotometri penyerapan atom
Kombinasi asetilena dan oksigen digunakan untuk membakar sampel asal yang berbeda dalam spektrofotometer serapan atom.
Selama prosedur, seberkas cahaya dari lampu dipengaruhi oleh nyala api, yang khusus untuk elemen yang diinginkan untuk diukur. Api menyerap cahaya lampu, memungkinkan kuantifikasi elemen.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Oksigen. Diperoleh dari: di.Wikipedia.org
- Richard Van Noordden. (13 September 2006). Hanya fase yang cantik? Oksigen merah padat: tidak berguna tapi menyenangkan. Pulih dari: alam.com
- Azonano. (4 Desember 2006). Struptur kristal E-fase oksigen padat ditentukan di sepanjang penemuan kluster O8 oksigen. Pulih dari: azonano.com
- Pusat Nasional Informasi Bioteknologi. (2019). Molekul oksigen. Database pubchem. CID = 977. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Kata. Doug Stewart. (2019). Fakta Elemen Oksigen. Chemicool. Pulih dari: chemicool.com
- Robert C. Brazted. (9 Juli 2019). Oksigen: Elemen Kimia. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Anak -anak wiki. (2019). Keluarga Oksigen: Sifat Via Elemen. Pulih dari: sederhana.Sains
- Advameg, Inc. (2019). Oksigen. Pulih dari: Makehow.com
- Lentech b.V. (2019). Tabel periode: oksigen. Pulih dari: lentech.com
- Departemen Kesehatan dan Layanan Senior New Jersey. (2007). Oksigen: Lembar fakta zat berbahaya. [PDF]. Pulih dari: NJ.Pemerintah
- Yamel Mattarollo. (26 Agustus 2015). Aplikasi Industri Industri. Pulih dari: altecdust.com
- « Neon History, Properties, Struktur, Risiko, Penggunaan
- Karakteristik histidin, struktur, fungsi, makanan »

