Proses isocoric
- 4652
- 226
- Ray Thiel
Apa itu proses isocoric?
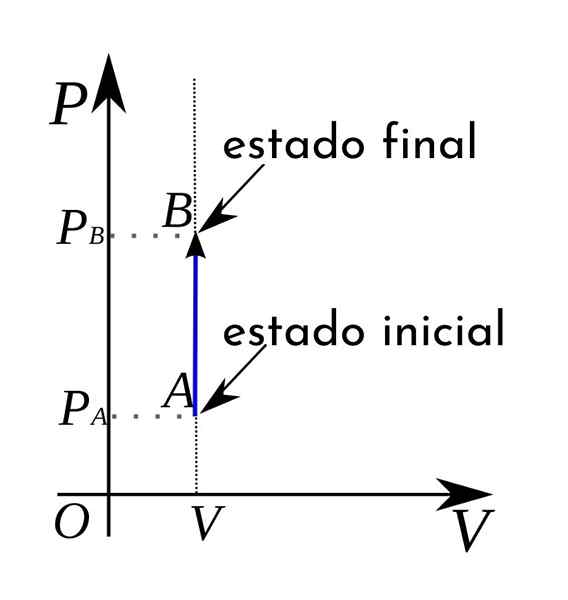
A Proses isocoric Itu adalah proses termodinamika di mana volume tetap konstan. Proses ini sering juga menerima nama isometrik atau isovolumetrik. Secara umum, proses termodinamika dapat terjadi pada tekanan konstan dan kemudian disebut isobarik.
Ketika itu terjadi pada suhu konstan, dalam hal ini dikatakan bahwa itu adalah proses isotermal. Jika tidak ada pertukaran panas antara sistem dan lingkungan, maka ada pembicaraan tentang adiabatik. Di sisi lain, ketika ada volume konstan, proses yang dihasilkan disebut isocoric.

Dalam kasus proses isokorik, dapat ditegaskan bahwa dalam proses ini, pekerjaan volume tekanan batal, karena ini hasil dari mengalikan tekanan dengan peningkatan volume.
Selain itu, dalam diagram tekanan-volume termodinamika proses isokorik diwakili dalam bentuk garis lurus vertikal.
Rumus dan Perhitungan
Prinsip pertama termodinamika
Dalam termodinamika, pekerjaan ini dihitung dari ekspresi berikut:
W = p ∙ ∆ v
Dalam ungkapan ini W adalah pekerjaan yang diukur dalam joule, p tekanan yang diukur dalam Newton per meter persegi, dan ∆ V adalah variasi atau peningkatan volume yang diukur dalam meter kubik.
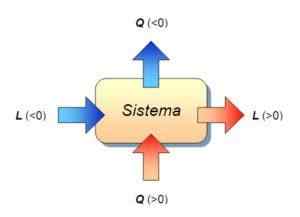
Demikian juga, yang dikenal sebagai prinsip pertama termodinamika menetapkan bahwa:
∆ u = q - w
Dalam rumus ini W adalah pekerjaan yang dilakukan oleh sistem atau pada sistem, yang merupakan panas yang diterima atau dikeluarkan oleh sistem, dan ∆ u Ini adalah variasi energi internal dari sistem. Pada kesempatan ini ketiga besaran diukur dalam joule.
Karena dalam proses isokoris, pekerjaannya nol, ternyata terpenuhi bahwa:
Dapat melayani Anda: Neptunus (planet)∆ u = qV (Karena, ∆ V = 0, dan karenanya w = 0)
Yaitu, variasi energi internal sistem hanya karena pertukaran panas antara sistem dan lingkungan. Dalam hal ini, panas yang ditransfer disebut panas ke volume konstan.
 Kapasitas panas pada volume konstan
Kapasitas panas pada volume konstan
Kapasitas panas suatu tubuh atau sistem dihasilkan dari membagi jumlah energi dalam bentuk panas yang ditransfer ke tubuh atau sistem dalam proses tertentu dan perubahan suhu yang dialami dengan hal yang sama.
Ketika proses dilakukan pada volume konstan, ia dibicarakan tentang kapasitas panas ke volume konstan dan dilambangkan dengan Cv (Kapasitas panas molar).
Itu akan dipenuhi dalam hal ini:
Qv = N ∙ Cv ∙ ∆t
Dalam situasi ini, n adalah jumlah mol, cv Ini adalah molar kapasitas panas yang disebutkan di atas untuk volume konstan dan ∆t adalah peningkatan suhu yang dialami oleh tubuh atau sistem.
Contoh harian proses isokoris
Mudah membayangkan proses isokoris, hanya perlu untuk memikirkan proses yang terjadi pada volume konstan; yaitu, di mana wadah yang berisi material atau sistem material tidak mengubah volume.
Contohnya bisa menjadi kasus (ideal) yang terkunci dalam wadah tertutup yang volumenya tidak dapat diubah dengan cara apa pun yang disediakan panas. Misalkan kotak gas yang terkunci dalam botol.
Dengan mentransfer panas ke gas, seperti yang sudah dijelaskan, itu akan berakhir menghasilkan peningkatan atau peningkatan energi internalnya.
Proses terbalik adalah dari gas yang tertutup dalam wadah yang volumenya tidak dapat dimodifikasi. Jika gas mendingin dan memberikan panas ke lingkungan, maka tekanan gas dan nilai energi internal gas akan berkurang akan berkurang.
Itu dapat melayani Anda: variabel diskrit: karakteristik dan contohOtto siklus yang ideal
Siklus Otto adalah kasus yang ideal dari siklus yang digunakan oleh mesin bensin. Namun, penggunaan awalnya adalah pada mesin yang menggunakan gas alam atau bahan bakar lainnya dalam keadaan gas.
Bagaimanapun, siklus ideal Otto adalah contoh yang menarik dari proses isokorik. Itu terjadi ketika di dalam mobil pembakaran internal, pembakaran campuran bensin dan udara terjadi secara instan.
Dalam hal ini, peningkatan tekanan suhu dan gas dalam silinder terjadi, tetap menjadi volume konstan.
Contoh praktis
Contoh pertama
Diberi gas (ideal) yang terkunci dalam silinder yang dilengkapi dengan piston, tunjukkan apakah kasus -kasus berikut adalah contoh dari proses isokoris.
- Pekerjaan 500 J pada Gas selesai.
Dalam hal ini tidak akan menjadi proses isokoris karena melakukan pekerjaan dengan gas, perlu untuk mengompresnya, dan oleh karena itu, mengubah volumenya.
- Gas mengembang secara horizontal piston.
Sekali lagi itu tidak akan menjadi proses isokoris, karena ekspansi gas menyiratkan variasi dalam volumenya.
- Piston silinder diperbaiki sehingga gas tidak dapat dipindahkan dan gas didinginkan.
Pada kesempatan ini itu akan menjadi proses isokoris, karena tidak akan ada variasi volume.
Contoh kedua
Tentukan variasi energi internal yang akan mengalami gas yang terkandung dalam wadah dengan volume 10 L yang diserahkan ke 1 atm tekanan, jika suhunya naik dari 34 ºC hingga 60 ° C dalam proses isokorik, diketahui panas molar panas spesifiknya spesifik Cv = 2.5 ·R (makhluk R = 8.31 j/mol · k).
Ini dapat melayani Anda: Graff Van Generator: Pihak, Cara Kerjanya, AplikasiKarena ini adalah proses volume konstan, variasi energi internal hanya akan terjadi sebagai akibat dari panas yang dipasok ke gas. Ini ditentukan dengan formula berikut:
Qv = N ∙ Cv ∙ ∆t
Untuk menghitung panas yang disediakan, pertama -tama diperlukan untuk menghitung mol gas yang terkandung dalam wadah. Untuk ini, perlu untuk menggunakan persamaan gas ideal:
P ∙ v = n ∙ r ∙ t
Dalam persamaan ini n adalah jumlah mol, R adalah konstanta yang nilainya 8,31 j/mol · k, t adalah suhu, p adalah tekanan yang diukur gas di atmosfer dan t dikenakan dan t adalah suhu yang diukur di Kelvin.
Itu dibersihkan dan diperoleh:
n = r ∙ t/ (p ∙ v) = 0, 39 mol
Sehingga:
∆ u = qV = N ∙ Cv ∙ ∆t = 0.39 ∙ 2.5 ∙ 8.31 ∙ 26 = 210.65 j

