Foundation, Prosedur dan Penggunaan Tes Oksidase
- 1307
- 24
- Joseph Nader PhD
Itu uji oksidase Ini adalah metode diagnostik yang menunjukkan adanya kompleks enzimatik yang disebut sitokrom oksidase C. Sistem ini menginduksi transformasi sitokrom yang dikurangi menjadi teroksidasi, karena menangkap oksigen dan ini pada gilirannya bertindak sebagai akseptor elektron terakhir (h+) Dalam rantai pernapasan.
Istilah oksidase adalah cara ringkasan merujuk pada enzim sitokrom oksidase, juga dikenal sebagai oksidase indefenol. Pada zaman kuno diyakini bahwa sitokrom oksidase dan enzim indeophenol oksidase adalah dua enzim yang berbeda, tetapi hari ini diketahui bahwa mereka sama.
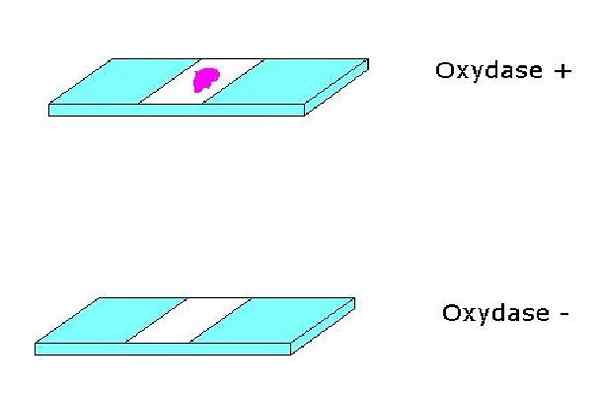
 Tes oksidase positif dan negatif. Sumber: Tidak ada penulis yang dapat dibaca mesin yang disediakan. Alfa.Prim ~ commonswiki diasumsikan (berdasarkan klaim hak cipta). [Area publik]
Tes oksidase positif dan negatif. Sumber: Tidak ada penulis yang dapat dibaca mesin yang disediakan. Alfa.Prim ~ commonswiki diasumsikan (berdasarkan klaim hak cipta). [Area publik] Untuk bagian mereka, sitokrom adalah hemoprotein yang mengandung zat besi dan melengkapi sistem sitokrom oksidase. Sitokrom dapat bervariasi dari satu spesies ke spesies lainnya.
Ada berbagai varietas sitokrom (sitokrom A1, A2, A3 dan 0). Beberapa bakteri hanya dapat menghasilkan satu, tetapi yang lain hingga dua atau tiga pada waktu yang sama. Dalam pengertian ini, keberadaan sitokrom A dan A3 dikenal sebagai sitokrom - oksidase C. Ini adalah jenis sitokrom yang mendeteksi uji oksidase.
Genre Neisseria dan Pseudomonas mengandung sitokom oksidase C. Genre ini memberikan uji oksidase positif, membantu membedakannya dari genre asinetobacter dan stenotrophomonas masing -masing.
Ada juga genre lain yang positif oksidase.
[TOC]
Dasar
Karakteristik sistem sitokrom oksidase c
Sistem Cychocroma oksidase bertindak sebagai berikut: mikroorganisme oksidase positif menggunakan oksigen untuk menghasilkan energi melalui pernapasan aerobik. Sistem ini berfungsi berkat pengangkutan elektron dari zat donor seperti NADH+ Menuju zat penerima, dalam hal ini oksigen.
Ini menghasilkan energi (ATP) dan air peroksida, tergantung pada sistem sitokrom oksidase yang memiliki mikroorganisme.
Itulah sebabnya sebagian besar bakteri oksidase positif juga katalase positif, kondisi yang diperlukan untuk menghilangkan hidrogen peroksida yang diproduksi, karena zat ini beracun bagi bakteri.
Sistem sitokom oksidase C hadir pada beberapa bakteri aerob, anaerob opsional tertentu, mikroaerofilik yang langka dan tidak ada anaerob yang ketat. Yang terakhir dapat dimengerti, karena anaerob yang ketat tidak dapat hidup di hadapan oksigen, oleh karena itu mereka tidak memiliki sistem sitokrom oksidase sitokrom.
Prinsip Bukti
Dalam tes ini menggunakan zat yang bertindak sebagai akseptor elektron buatan, mengganti penduduk asli dalam rantai transportasi elektron.
Terutama pewarna seperti paraphenylendiamine dan indophenol digunakan, yang bertindak sebagai substrat reseptor dan donor elektron buatan.
Paraphenyndiamine dioksidasi oleh sistem sitokom oksidase C. Pewarna dalam bentuk tereduksi tidak berwarna, tetapi dalam bentuk teroksidasi itu diwarnai.
Beginilah keberadaan sistem C sitokrom oksidase C; Nah, reaksi positif akan menghasilkan lavender atau warna biru -púrpura tergantung pada reagen yang digunakan.
Dapat melayani Anda: paleobiologi: sejarah, spesialisasi, penemuanDi sisi lain, jika zat akseptor elektron terakhir dalam rantai pernapasan berbeda dari oksigen, uji oksidase akan memberikan negatif (tidak ada produksi warna); Ini adalah kasus mikroorganisme anaerob.
Demikian juga, jika sitokrom yang digunakan oleh mikroorganisme berbeda dari sitokrom oksidase C, itu juga akan memberikan tes negatif.
Prosedur
Untuk uji oksidase ada beberapa reagen dan protokol, semuanya dengan tujuan yang sama.
Reagen
Kovacs Reaktif, Reagen Gordon dan McLeod, Reagen Nadi, Reagen Carpenter, Suhrland dan Morrison, dan penggunaan cakram oksidase.
-Reagen Kovacs Oxidase
Ini terdiri dari tetramethyl-p-phenylendiamine dichlorhydrate pada 1%.
Reagen Kovacs disiapkan dengan melarutkan 1 gr zat yang disebutkan dalam 50 ml air suling. Itu secara halus dipanaskan sampai solusi totalnya. Transfer ke botol kuning dengan kapasitas yang cukup dan selesaikan volume pada 100 mL dengan air suling. Tunggu setidaknya 15 menit sebelum menggunakan. Simpan di lemari es yang dilindungi dari cahaya.
Diputar sebagai reagen Kovacs oksidase, untuk membedakannya dari reagen Kovac yang digunakan untuk mengungkapkan uji indol. Reagen ini adalah yang paling sensitif, kurang beracun tetapi lebih mahal daripada reagen lainnya.
Reaksi positif akan menjadi bukti. Reaksi negatif dibuktikan karena tidak ada perubahan warna di koloni atau membutuhkan sedikit warna merah muda. Media juga bisa gelap, tetapi itu tidak berarti reaksi positif.
Dengan reagen ini, waktu reaksi sangat penting, perubahan warna yang terjadi antara 5 hingga 15 detik dianggap sebagai reaksi positif.
-Reagen Gordon dan McLeod
Ini terdiri dari dimethyl-p-phenylendiamine dichlorhydrate, juga dikenal sebagai N-dimethyl-p-phenylendiamine atau p-amynodimethyiline p-amocorhydrate p-amocorhydrate. Disiapkan seperti yang dijelaskan untuk reagen oksidase Kovacs, mengganti zat yang terlibat.
Reagen ini sedikit lebih stabil daripada reagen Kovacs oksidase, meskipun semua reagen yang mengandung p-penilendiamine tidak stabil.
Reaksi ini terlambat.
-Reagen Nadi
Ini terdiri dari 1% α-naftol dalam etil alkohol (etanol 95%) dan 1% amin-limanlin. Campuran disiapkan di bagian yang sama dan menggunakan etil alkohol absolut sebagai pengadu, sampai jumlah yang cukup diselesaikan selama 100 mL.
-Tukang kayu reaktif, suhrland dan morrison
Ini terdiri dari 1% p-amynodimethylalanine oksalat. Persiapkan dengan cara yang sama untuk yang dijelaskan untuk reagen oksidase Kovacs, berubah untuk zat yang sesuai.
Dapat melayani Anda: rantai makanan hutanDengan larutan siap, strip reaktif disiapkan sebagai berikut: Whatman 6-8 cm Nomor 1.
Mereka dibiarkan kering tanpa kontak dengan logam, simpan di benang guci dengan pengeringan dan simpan di lemari es. Strip ini stabil hingga 6 bulan.
Ini adalah reagen paling stabil dari semua yang disebutkan, mampu bertahan dalam solusi hingga 6 bulan. Poin lain yang mendukung bahwa media tidak berwarna di sekitar koloni, jika digunakan langsung di piring.
Penampilan warna merah ditafsirkan sebagai tes positif.
-Cakram oksidase
Mereka adalah cakram komersial yang diresapi dengan reagen untuk uji oksidase. Ada beberapa merek komersial di pasar.
Penggunaannya cukup praktis, karena kita tidak boleh menyiapkan reagen baru, yang memfasilitasi pekerjaan. Hasil yang diperoleh dapat diandalkan selama cakram dipertahankan dengan benar.
Protokol
Metode pelat langsung, metode tidak langsung pada kertas dan penggunaan cakram yang diresapi dengan reagen oksidase.
-Metode pelat langsung
2 atau 3 tetes reagen yang disebutkan di atas ditambahkan untuk tujuan ini langsung di koloni yang terkandung dalam pelat medium kultur yang tidak mengandung glukosa.
Perubahan atau tidak warna koloni ditafsirkan, bukan medium. Waktu reaksi yang valid tergantung pada reagen yang digunakan.
-Metode tidak langsung di atas kertas
Potong selembar kertas saring (whatman n ° 1) hingga ukuran 6 cm2 Dan ditempatkan di dalam petri kosong.
Tambahkan 2 atau 3 tetes reagen oksidase Kovacs di atas kertas, ambil bagian dalam koloni yang ingin Anda pelajari dengan pegangan platinum atau tongkat kayu dan memperpanjangnya dalam garis lurus pada kertas reagen reagen yang diresapi. Menafsirkan dalam periode 5 hingga 10 detik.
Dengan strip yang disiapkan dengan tukang kayu, suhrland dan morrison reagen sebuah koloni memanjang di strip kering. Strip yang sama berfungsi untuk mencoba beberapa strain. Menafsirkan pada 10 detik.
-Cakram (mEtod Langsung)
Lembab secara halus cakram komersial dengan air suling steril dan mengatasi koloni untuk belajar. Disarankan untuk menggunakan pelat pada suhu 35 ° C, jika pelat digunakan pada suhu kamar atau pelat yang didinginkan reaksinya sedikit lebih lambat. Menafsirkan perubahan warna antara 10 hingga 20 detik.
Koloni yang terkandung dalam darah atau cokelat dapat digunakan.
-Disc (metode tidak langsung)
Basahi album seperti yang dijelaskan di atas. Letakkan di atas petri kosong. Ambil jumlah koloni yang cukup untuk belajar dengan pegangan platinum atau tongkat kayu dan tempatkan pada cakram. Menafsirkan perubahan warna antara 10 hingga 20 detik.
Menggunakan
Genus Neisseria dan Acinetobacter kadang -kadang menyerupai banyak morfologis karena meskipun genre asinetobacter adalah bacillus negatif gram, kadang -kadang dapat mengadopsi bentuk kokoid dan mendistribusikan berpasangan, mensimulasikan genus Neisseria.
Dapat melayani Anda: limnologiDalam hal ini uji oksidase sangat berguna. Neisseria gender adalah Acinetobacter positif dan negatif.
Namun, genus Moraxella sangat mirip dengan genus Neisseria dan keduanya memberikan reaksi positif; Itulah sebabnya kami selalu harus melakukan tes fermentasi karbohidrat untuk identifikasi definitif.
Di sisi lain, uji oksidase berguna untuk membedakan bakteri yang termasuk dalam keluarga Enterobacteriaceae (semua oksidase negatif) dari fermer lainnya, seperti genus pasturel, aeromon, plesiomonas (oksidase positif).
Genus Vibrio dan Helicobacter juga merupakan oksidase positif.
Qa
Gunakan strain yang dikenal Escherichia coli sebagai kontrol dan ketegangan negatif Pseudomonas aeruginosa sebagai kontrol positif.
Batasan
-Reagen harus digunakan yang baru disiapkan, masa manfaatnya dalam suhu kamar adalah kependekan dari menjadi sangat tidak stabil. Didinginkan dapat bertahan antara 5 hari hingga 2 minggu.
-Reagennya tidak berwarna, jika mereka berubah warna, mereka harus dibuang. Cakram yang rusak terbukti karena mereka menjadi gelap seiring waktu.
-Reaksi positif dengan reagen oksidase Kovacs antara 15 -60 detik dianggap sebagai reaksi tertunda dan setelah 60 detik harus dianggap negatif.
-Dia Haemophylus influenzae Ini memberikan reaksi oksidase negatif jika ada reagen dengan dimetil-p-phenylendiamine digunakan, tetapi positif jika reagen oksidase kovac (tetramethyl-p-phenylendiamine) digunakan berguna).
-Media yang mengandung glukosa mengganggu tes, secara salah negatif.
-Strain Bordetella pertusis Mereka dapat memberikan reaksi positif yang salah jika mereka berasal dari pelat agar darah yang sangat terkonsentrasi.
-Penggunaan pegangan logam (besi) memberikan reaksi positif yang salah.
Rekomendasi
-Karena reagennya sangat tidak stabil dan cenderung keluar sendiri.
-Cara lain untuk menunda outlet diri reagen adalah dengan menambahkan 0,1% asam askorbat pada saat menyiapkan reagen.
-Karena reagen tidak stabil, disarankan untuk melakukan kontrol kualitas mingguan.
-Reagen yang tidak lulus tes kontrol kualitas tidak boleh digunakan.
Referensi
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosis mikrobiologis. Edisi ke -5. Pan -American Editorial S.KE. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosis mikrobiologis Bailey & Scott. 12 ed. Pan -American Editorial S.KE. Argentina.
- "Tes oksidase." Wikipedia, ensiklopedia gratis. Jan 2018, 10:32 UTC. Apr 2019, 14:03
- Organisasi Kesehatan Dunia. Manual Laboratorium Untuk Identifikasi dan Uji Kerentanan terhadap Antimikrobia Patogen Bakteri Pentingnya bagi Kesehatan Masyarakat di Dunia Pembangunan.2004. Tersedia di: Siapa.Int/rocetresistance/infosharing
- Strip reaktif untuk diagnosis aktivitas oksidase pada bakteri. Rev Kuba. 2000; 52 (2): 150-151.

