Radio atom
- 4773
- 477
- Miss Marion Graham
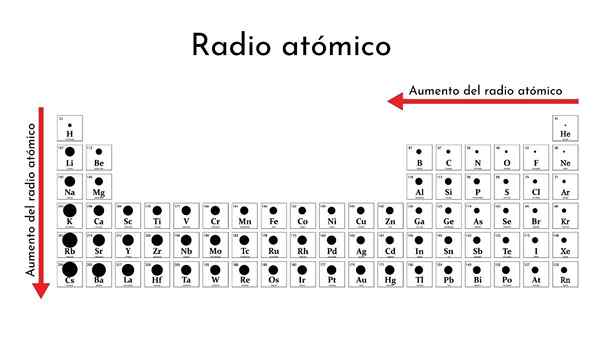
 Tabel periodik elemen dengan radio atom
Tabel periodik elemen dengan radio atom Apa itu radio atom?
Dia radio atom Ini adalah parameter penting untuk sifat periodik elemen tabel periodik. Itu secara langsung terkait dengan ukuran atom, karena radio yang lebih besar, lebih besar atau tebal. Demikian juga, ini terkait dengan karakteristik elektronik yang sama.
Sementara atom memiliki lebih banyak elektron, semakin besar ukuran atom dan radionya. Keduanya ditentukan oleh elektron lapisan valencia, karena pada jarak di luar orbitnya, probabilitas menemukan elektron mendekati nol. Sebaliknya terjadi di sekitar nukleus: probabilitas menemukan elektron meningkat.
 Paket Bola Kapas. Cara mereka dipadatkan menentukan ukuran dan radio mereka, dengan cara yang sama yang terjadi dengan atom
Paket Bola Kapas. Cara mereka dipadatkan menentukan ukuran dan radio mereka, dengan cara yang sama yang terjadi dengan atom Gambar atas mewakili kemasan bola kapas. Perhatikan bahwa masing -masing dikelilingi oleh enam tetangga, tidak menghitung mungkin atau baris bawah lainnya. Cara bola kapas dipadatkan akan menentukan ukurannya dan, oleh karena itu, radio mereka; seperti atom.
Unsur -unsur sesuai dengan sifat kimianya berinteraksi dengan atom mereka sendiri dengan satu atau lain cara. Oleh karena itu, besarnya jari -jari atom bervariasi sesuai dengan jenis ikatan yang ada dan dengan kemasan padat atomnya.
Bagaimana jari -jari atom diukur?
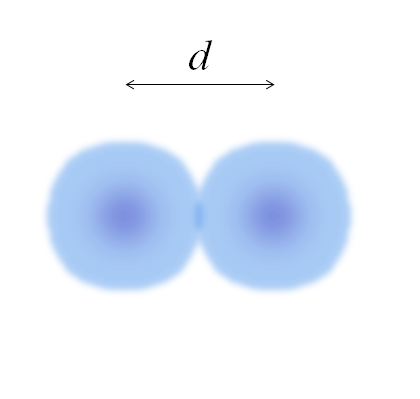 Gambar dua atom, yang ujungnya tidak sepenuhnya didefinisikan. Sumber: Gabriel Bolívar
Gambar dua atom, yang ujungnya tidak sepenuhnya didefinisikan. Sumber: Gabriel Bolívar Pada gambar sebelumnya bisa sederhana. Namun, bola atom tidak sepenuhnya ditentukan. Karena? Karena elektron beredar dan kabur di daerah beton ruang: orbital.
Oleh karena itu, atom dapat dianggap sebagai bola dengan tepi yang tidak bisa ditembus, yang tidak mungkin untuk dikatakan dengan pasti di mana mereka berakhir. Misalnya, dalam gambar superior wilayah pusat, dekat dengan nukleus, terlihat warna yang lebih intens, sedangkan ujungnya kabur.
Dapat melayani Anda: solvasiGambar tersebut mewakili molekul diatomik dan2 (Seperti CL2, H2, SALAH SATU2, dll.). Dengan asumsi bahwa atom adalah benda bulat, jika jarak ditentukan D Itu memisahkan kedua nuklei dalam tautan kovalen, kemudian akan cukup untuk membaginya menjadi dua bagian (D/2) untuk mendapatkan jari -jari atom; Lebih tepatnya, jari -jari kovalen E untuk e2.
Bagaimana jika E tidak membentuk ikatan kovalen dengan dirinya sendiri, tetapi itu adalah elemen logam? Jadi D Itu akan ditunjukkan oleh jumlah tetangga di sekitar E dalam struktur logam mereka; yaitu, dengan nomor koordinasi (n.C) dari atom di dalam kemasan (ingat bola kapas gambar).
Penentuan jarak internuclear
Untuk menentukan D, yang merupakan jarak internuclear untuk dua atom dalam molekul atau pengemasan, teknik analisis fisik diperlukan.
Salah satu yang paling banyak digunakan adalah difraksi x -ray. Ini memancarkan sinar cahaya melalui kaca, dan pola difraksi yang dihasilkan dari interaksi antara elektron dan radiasi elektromagnetik dipelajari.
Tergantung pada pengemasan, pola difraksi yang berbeda dapat diperoleh dan oleh karena itu, nilai -nilai lain dari D.
Jika atom "kencang" di jaringan kristal, mereka akan menyajikan nilai yang berbeda dari D dibandingkan dengan mereka yang akan memilikinya jika mereka "nyaman".
Demikian juga, jarak internuclear ini dapat berkisar dari nilai, sehingga jari -jari atom sebenarnya terdiri dari nilai rata -rata pengukuran tersebut.
Bagaimana radius atom dan nomor koordinasi berhubungan? V. Goldschmidt menjalin hubungan antara keduanya, di mana untuk n.C dari 12, nilai relatif adalah 1; dari 0.97 untuk kemasan di mana atom memiliki n.C sama dengan 8; dari 0.96, untuk n.C sama dengan 6; dan 0.88 untuk an n.C dari 4.
Dapat melayani Anda: natrium permanganate (namno4): properti, risikoUnit
Dari nilai untuk n.C sama dengan 12, banyak tabel telah dibangun di mana radio atom dari semua elemen dari tabel periodik dibandingkan.
Karena tidak semua elemen membentuk struktur kompak seperti itu (n.C kurang dari 12), rasio V digunakan. Goldschmidt untuk menghitung radio atom mereka dan mengekspresikannya untuk pengemasan yang sama. Dengan cara ini pengukuran radio atom distandarisasi.
Tapi unit apa yang diungkapkan? Mengingat D Ini sangat kecil, unit angstrom Å (10 ∙ 10-10m) atau juga banyak digunakan, picometer (10 ∙ 10-12M).
Bagaimana Anda mengubah tabel periodik?
Selama periode
Radio atom yang ditentukan untuk elemen logam disebut radio logam, sedangkan untuk elemen non -metalik, radio kovalen (seperti fosfor, p4, atau belerang, s8). Namun, antara kedua jenis radio ada perbedaan yang lebih menonjol daripada namanya.
Dari kiri ke kanan pada periode yang sama, nukleus menambahkan proton dan elektron, tetapi yang terakhir terbatas pada tingkat energi yang sama (angka kuantum utama).
Sebagai akibatnya, nukleus menjalankan beban nuklir yang efektif pada elektron valensi, yang mengontrak jari -jari atom.
Dengan cara ini, elemen non -metalik dalam periode yang sama cenderung memiliki radio atom (kovalen) yang lebih kecil.
Turun oleh grup
Saat turun oleh grup, tingkat energi baru diaktifkan, yang memungkinkan elektron memiliki lebih banyak ruang. Dengan demikian, awan elektronik mencakup jarak yang lebih besar, pinggirannya yang kabur berakhir lebih dari nukleus, dan, oleh karena itu, jari -jari atom mengembang.
Dapat melayani Anda: grup hidroksilKontraksi lantanida
Elektron lapisan dalam membantu menyinari beban nuklir yang efektif pada elektron valensi. Ketika orbital yang membentuk lapisan internal memiliki banyak "lubang" (node), seperti halnya dengan orbital f, nukleus sangat mengontrak jari -jari atom karena efek perisai yang buruk dari mereka.
Fakta ini dibuktikan dalam kontraksi lantanida dalam periode 6 dari tabel periodik. Dari HF ada kontraksi yang cukup besar dari produk jari -jari atom orbital f, yang “diisi” sebagai blok f: yaitu lantanoides dan aktinoid dilalui.
Efek serupa juga dapat diamati dengan elemen blok P dari periode 4. Produk waktu ini dari efek pelindung lemah dari orbital D yang diisi dengan bepergian periode logam transisi.
Contoh Radio Atom
Untuk periode 2 dari tabel periodik, radio atom elemennya adalah:
-Li: 257 PM
-BE: 112 PM
-B: 88 PM
-C: 77 PM
-N: 74 PM
-O: 66 PM
-F: 64 PM
Perhatikan bahwa logam lithium memiliki jari -jari atom terbesar (257 pm), sedangkan fluor, terletak di ujung kanan periode, adalah yang terkecil dari semuanya (64 sore). Jari -jari atom turun dari kiri ke kanan pada periode yang sama, dan nilai daftar menunjukkannya.
Lithium, dengan membentuk ikatan logam, jari -jarinya adalah logam; dan fluoride, sebagai bentuk ikatan kovalen (f-f), jari-jarinya adalah kovalen.
Bagaimana jika Anda ingin mengekspresikan radio atom dalam unit angstrom? Itu akan cukup untuk membaginya dengan 100: (257/100) = 2.57å. Dan seterusnya dengan nilainya.
Referensi
- Kimia 301. Radii Atom. Dipulihkan dari: CH301.cm.Utexas.Edu
- CK-12 Foundation (2016). Radius atom. Pulih dari: chem.Librettexts.org
- Tren radius atom. Diambil dari: intro.Chem.Okstate.Edu
- Clackamas Community College (2002). Ukuran atom. Diperoleh dari: DL.Clackamas.Edu
- Clark J. (2012). Radius atom dan ionik. Pulih dari: chemguide.bersama.Inggris
- Shiver & Atkins. (2008). Kimia Anorganik (Edisi Keempat, hlm. 23, 24, 80, 169). MC Graw Hill.

