Karakteristik dan contoh reaksi exergonic

- 2248
- 530
- Jessie Harvey
A reaksi eksergonik Ini adalah salah satu yang terjadi secara spontan dan, secara umum, disertai dengan pelepasan energi, baik dalam bentuk panas, cahaya atau suara. Saat panas dilepaskan, dikatakan bahwa kita menghadapi reaksi eksotermik dan eksergonik.
Itulah sebabnya istilah 'eksotermik' dan 'eksergonik' bingung, menjadi keliru diperlakukan sebagai sinonim. Ini karena banyak reaksi eksotermik juga eksergonis. Oleh karena itu, jika detasemen besar panas dan cahaya diamati, seperti asal api, dapat diasumsikan bahwa itu terdiri dari reaksi eksergonik.
 Pembakaran kayu adalah contoh dari eksotermik dan pada saat yang sama reaksi eksergonik. Sumber: Pixnio.
Pembakaran kayu adalah contoh dari eksotermik dan pada saat yang sama reaksi eksergonik. Sumber: Pixnio. Namun, energi yang dilepaskan bisa tidak diperhatikan dan tidak begitu mengejutkan. Misalnya, media cair dapat memanas sedikit dan belum menjadi konsekuensi dari reaksi eksergonik. Dalam beberapa reaksi eksergonik yang berlalu terlalu lambat, kenaikan suhu terendah bahkan tidak diamati.
Titik pusat dan karakteristik dari jenis reaksi termodinamika ini adalah penurunan energi bebas Gibbs dalam produk sehubungan dengan reagen, yang diterjemahkan ke dalam spontanitas.
[TOC]
Karakteristik reaksi eksergonik
Diagram Umum
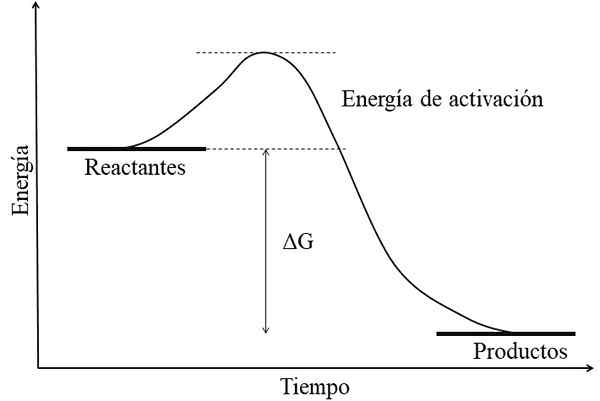 Diagram Energi untuk Reaksi Exergonic. Sumber: Gabriel Bolívar.
Diagram Energi untuk Reaksi Exergonic. Sumber: Gabriel Bolívar. Karakteristik utama dari reaksi eksergonik adalah bahwa produk memiliki energi bebas GIBS lebih rendah daripada reaktan atau reagen (gambar superior). Fakta ini biasanya dikaitkan dengan produk secara kimia lebih stabil, dengan tautan yang lebih kuat, struktur yang lebih dinamis atau lebih banyak kondisi "nyaman".
Oleh karena itu, perbedaan energi ini, ΔG, adalah negatif (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Dapat melayani Anda: sistem homogenSemua variabel ini yang merespons sifat fenomena atau reaksi kimia yang dipertimbangkan, memungkinkan untuk menentukan apakah suatu reaksi akan menjadi eksergonik atau tidak. Dan juga akan terlihat bahwa itu tidak harus menjadi reaksi eksotermik.
Ketika energi aktivasi sangat tinggi, reaktan membutuhkan bantuan katalis untuk mengurangi penghalang energi tersebut. Itulah sebabnya ada reaksi eksergonik yang diberikan pada kecepatan yang sangat rendah, atau yang tidak terjadi sama sekali.
Penurunan energi bebas dalam sistem
Ekspresi matematika berikut mencakup apa yang dikomentari di atas:
ΔG = ΔH - TΔS
Istilah ΔH positif jika itu adalah reaksi endotermik, dan negatif jika eksotermik. Jika kita ingin ΔG menjadi negatif, istilah TΔS harus sangat besar dan positif, sehingga ketika mengurangi ΔH hasil operasi juga negatif.
Oleh karena itu, dan ini adalah karakteristik khusus lain dari reaksi eksergonik: mereka menyiratkan perubahan besar dalam entropi sistem.
Dengan demikian, dengan mempertimbangkan semua persyaratan, kita dapat hadir sebelum reaksi eksergonik tetapi pada saat yang sama endotermik; yaitu, dengan ΔH positif, suhu yang sangat tinggi, atau perubahan entropi besar.
Sebagian besar reaksi eksergonik juga eksotermik, karena jika ΔH negatif, dan dengan mengurangi istilah lain yang lebih negatif, kita akan memiliki ΔG dengan nilai negatif; Kecuali TΔS adalah negatif (entropi turun), dan oleh karena itu reaksi eksotermik akan menjadi endogonik (tidak spontan).
Penting untuk menyoroti bahwa spontanitas suatu reaksi (apakah exergonic atau tidak), sangat tergantung pada kondisi termodinamika; Sedangkan kecepatan yang dilewati, adalah karena faktor kinetik.
Itu dapat melayani Anda: materi hidup: konsep, karakteristik dan contohSpontanitas reaksi eksergonik
Apa yang telah dikatakan diketahui karena reaksi eksergonik adalah spontan, apakah eksotermik. Misalnya, senyawa dapat larut dalam air mendinginkannya bersama dengan wadahnya. Proses pembubaran ini adalah endotermik, tetapi ketika itu terjadi secara spontan, dikatakan bahwa itu adalah Exergonic.
Reaksi eksotermik
Ada reaksi "lebih eksergonik" daripada yang lain. Untuk mengetahuinya, ungkapan berikut harus ada:
ΔG = ΔH - TΔS
Reaksi yang paling eksergonik adalah yang diberikan secara spontan untuk semua suhu. Yaitu, terlepas dari nilai t dalam ekspresi sebelumnya, ΔH negatif dan ΔS positif (ΔH 0). Karena itu mereka adalah reaksi yang sangat eksotermik, yang tidak bertentangan dengan ide awal.
Mungkin juga ada reaksi eksotermik di mana entropi sistem berkurang (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Reaksi endotermik
Di sisi lain, ada reaksi yang hanya spontan pada suhu tinggi: ketika ΔH positif dan ΔS positif (ΔH> 0 dan ΔS> 0). Kami berbicara tentang reaksi endotermik. Itulah sebabnya keturunan suhu dapat terjadi secara spontan, karena mereka membawa peningkatan entropi.
Sementara itu, ada reaksi yang tidak eksergonik sama sekali: ketika ΔH dan ΔS memiliki nilai positif. Dalam hal ini, apa pun suhunya, reaksinya tidak akan pernah terjadi secara spontan. Kami berbicara kemudian, tentang reaksi akhir -spontan akhir.
Dapat melayani Anda: fase dispersingContoh reaksi eksergonik
Kimia biasanya ditandai dengan menjadi eksplosif dan brilian, sehingga diasumsikan bahwa sebagian besar reaksi bersifat eksotermik dan eksergonik.
Pembakaran
Reaksi eksergonik adalah pembakaran alkana, olefin, hidrokarbon aromatik, gula, dll.
Oksidaks logam
Demikian juga, oksidasi logam eksergonik, meskipun mereka lewat lebih lambat.
Reaksi katabolik organisme
Namun, ada proses lain yang lebih halus, yang juga eksergonik dan sangat penting: reaksi katabolik dari metabolisme kita. Di sini makromolekul terurai itu bertindak sebagai reservoir energi, membebaskan diri mereka dalam panas dan ATP, dan berkat tubuh yang melakukan banyak fungsinya.
Reaksi yang paling lambang ini adalah respirasi seluler, berlawanan dengan fotosintesis, di mana karbohidrat dengan oksigen "dibakar" untuk mengubahnya menjadi molekul kecil (CO2 dan H2O) dan energi.
Yang lain
Di antara reaksi eksergonik lainnya, kami memiliki dekomposisi eksplosif dari triayoduro nitrogen, atau3; penambahan logam alkali air, diikuti oleh ledakan; Sintesis polimer dari resin beretoksilasi; netralisasi asam-basa dalam larutan berair; dan reaksi kemo luminescent.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Walter J. Moore. (1963). Kimia Fisik. Dalam Kinetika Kimia. Edisi Keempat, Longmans.
- Iran. Levine. (2009). Prinsip -prinsip fisikokimia. Edisi Keenam, Halaman 479-540. MC Graw Hill.
- Wikipedia. (2020). Reaksi eksergonik. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (16 September 2019). Reaksi dan proses endergonik vs exergonic. Pulih dari: thinkco.com
- Reaksi Exergonic: Definisi & Contoh. (18 September 2015). Pulih dari: belajar.com
- Akademi Khan. (2018). Energi bebas. Pulih dari: is.Khanacademy.org
- « Rumus Energi Mekanik, Konsep, Jenis, Contoh, Latihan
- Konsumsi berkelanjutan untuk apa penggunaan, pentingnya, tindakan, contoh »

