Sejarah Silikon, Sifat, Struktur, Perolehan, Penggunaan

- 1449
- 246
- Pete Lesch
Dia silikon Ini adalah elemen non -metalik dan pada saat yang sama metaloid yang diwakili oleh simbol kimia jika. Ini adalah semikonduktor, yang merupakan bagian penting dari komputer, kalkulator, ponsel, sel surya, dioda, dll.; Ini adalah komponen utama yang memungkinkan penyelesaian era digital.
Silikon selalu hadir dalam kuarsa dan silikat, kedua mineral yang menyusun sekitar 28% dalam massa seluruh kerak bumi. Dengan demikian itu adalah elemen paling melimpah kedua di permukaan bumi, dan luasnya padang pasir dan pantai menawarkan perspektif betapa berlimpahnya hal itu.
 Gurun adalah sumber alami yang berlimpah dari partikel silika atau granit dengan mineral lain. Sumber: Pxhere.
Gurun adalah sumber alami yang berlimpah dari partikel silika atau granit dengan mineral lain. Sumber: Pxhere. Silikon milik kelompok 14 dari tabel periodik, sama seperti karbon, yang terletak di bawah ini. Itulah sebabnya elemen ini dianggap sebagai metalloid tetravalent; Ini memiliki empat elektron Valencia dan secara teori Anda bisa kehilangan semuanya untuk membentuk kation jika4+.
Properti yang berbagi dengan batubara adalah kemampuannya untuk menggabungkan; yaitu, atom mereka terkait secara kovalen untuk mendefinisikan rantai molekul. Demikian juga, silikon dapat membentuk "hidrokarbon" sendiri, yang disebut siltans.
Senyawa dominan silikon di alam adalah silikat yang terkenal. Dalam bentuk murni dapat terjadi sebagai monokristalin yang kokoh, polyristaline atau amorf. Ini adalah padatan yang relatif lembam, jadi tidak mewakili risiko yang cukup besar.
[TOC]
Sejarah
Batu Silikon
Silikon mungkin merupakan salah satu elemen yang paling berpengaruh pada sejarah kemanusiaan.
Elemen ini adalah protagonis zaman batu, dan juga dari era digital. Asal -usul mereka tanggal kembali ketika peradaban bekerja dengan kuarsa dan membuat gelas mereka sendiri; Dan saat ini, ini adalah komponen utama komputer, laptop, dan smartphone.
Praktis silikon telah menjadi batu dari dua era yang jelas didefinisikan dalam sejarah kita.
Isolasi
Ketika silika sangat berlimpah, nama yang lahir dari batu batu, itu harus mengandung unsur yang sangat kaya di kerak bumi; Ini adalah kecurigaan yang sukses dari Antoine Lavoisier, yang pada 1787 gagal dalam upayanya untuk menguranginya dari oksidanya.
Beberapa waktu kemudian, pada tahun 1808 Humphry Davy melakukan upayanya sendiri dan menugaskan nama depannya ke elemen: 'silicium', yang diterjemahkan akan seperti 'logam pedernal'. Artinya, silikon saat itu dianggap sebagai logam karena kurangnya karakterisasi.
Kemudian, pada tahun 1811 ahli kimia Prancis Joseph L. Gay-Lussac dan Louis Jacques Thénard berhasil mempersiapkan silikon amorf untuk pertama kalinya. Untuk ini mereka bereaksi silikon tetrafluoride dengan kalium logam. Namun, mereka tidak memurnikan atau mengkarakterisasi produk yang diperoleh, sehingga mereka tidak menyimpulkan bahwa itu adalah elemen silicium baru.
Itu tidak lain adalah pada tahun 1823 ketika ahli kimia Swedia Jacob Berzelius memperoleh silikon amorf dengan kemurnian yang cukup untuk mengenalinya sebagai silikon; Nama yang diberikan pada tahun 1817 oleh ahli kimia Skotlandia Thomas Thomson saat mempertimbangkannya sebagai elemen non -metalik. Berzelius melakukan reaksi antara kalium dan kalium cair fluorosilikat untuk menghasilkan silikon ini.
Silikon kristal
Silikon kristal disiapkan untuk pertama kalinya pada tahun 1854 oleh ahli kimia Prancis Henry Deville. Untuk mencapai hal ini, Deville membuat elektrolisis dari campuran aluminium dan natrium klorida, sehingga mendapatkan kristal silikon yang ditutupi oleh lapisan aluminium siliciuro, yang menghilangkan (tampaknya) mencuci air dengan air dengan air dengan air.
Sifat fisik dan kimia
Penampilan fisik
 Silikon elementer, yang memiliki kilau logam, tetapi sebenarnya adalah metalloid. Sumber: Gambar Hi-Res dari Elemen Kimia [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Silikon elementer, yang memiliki kilau logam, tetapi sebenarnya adalah metalloid. Sumber: Gambar Hi-Res dari Elemen Kimia [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Silikon dalam bentuk murni atau dasarnya terdiri dari solid keabu -abuan atau padatan hitam (gambar superior), yang meskipun bukan logam, menyajikan wajah -wajah cerah seolah -olah itu sebenarnya dulu.
Ini adalah padatan yang keras tetapi rapuh, yang juga menunjukkan permukaan skuamosa jika dibentuk oleh polyristales. Di sisi lain, silikon amorf terlihat seperti padatan bubuk coklat gelap. Berkat ini, mudah untuk mengidentifikasi dan membedakan satu jenis silikon (kristal atau polyristaline) dari yang lain (amorf).
Masa molar
28.085 g/mol
Nomor Atom (Z)
14 (14Ya)
Titik lebur
1414 ºC
Titik didih
3265 ºC
Kepadatan
-Pada suhu kamar: 2,33 g/ml
-Tepat di titik leleh: 2,57 g/ml
Perhatikan bahwa silikon cair lebih padat daripada silikon padat; yang berarti kristal mereka akan melayang pada fase cair, seperti halnya sistem air es. Penjelasannya adalah karena fakta bahwa ruang interatomik antara atom jika di gelasnya lebih besar (kurang padat), daripada yang sesuai dalam cairan (lebih padat).
Panas fusi
50.21 kJ/mol
Panas penguapan
383 kJ/mol
Kapasitas panas molar
19.789 J/(mol · k)
Elektronegativitas
1.90 pada skala Pauling
Energi ionisasi
-Pertama: 786.5 kJ/mol
-Kedua: 1577.1 kJ/mol
-Ketiga: 3231.6 kJ/mol
Radio atom
111 PM (diukur dalam kristal berlian masing -masing)
Konduktivitas termal
149 w/(m · k)
Resistivitas listrik
2.3 · 103 Ω · m hingga 20 ºC
Kekerasan Mohs
6.5
Rangkaian
Atom silikon memiliki kemampuan untuk membentuk tautan si-si sederhana, yang akhirnya mendefinisikan rantai (si-si-si ...).
Properti ini juga dimanifestasikan oleh karbon dan belerang; Namun, hibridisasi SP3 silikon lebih kurang dibandingkan dengan dua elemen lainnya dan, di samping itu, orbital 3p mereka lebih difus, sehingga tumpang tindih orbital SP3 yang dihasilkan lebih lemah.
Dapat melayani Anda: reaksi eksotermik dan endotermikEnergi rata-rata ikatan kovalen Si-Si dan C-C adalah 226 kJ/mol dan 356 kJ/mol, masing-masing. Oleh karena itu, tautan Si-jika lebih lemah. Karena itu, silikon bukanlah landasan kehidupan (atau belerang). Faktanya, rantai atau kerangka terpanjang yang dapat dibentuk silikon biasanya adalah empat anggota (jika4).
Angka oksidasi
Silikon dapat memiliki nomor oksidasi berikut, dengan asumsi masing -masing keberadaan ion dengan beban masing -masing: -4 (ya4-), -3 (ya3-), -2 (ya2-), -1 (ya-), +1 (ya+), +2 (ya2+), +3 (ya3+) dan +4 (ya4+). Dari semuanya, -4 dan +4 adalah yang paling penting.
Misalnya, -4 diasumsikan dalam siliciuros (mg2Ya atau mg22+Ya4-); sementara +4 sesuai dengan silika (sio2 atau jika4+SALAH SATU22-).
Reaktivitas
Silikon benar -benar tidak larut dalam air, serta asam atau basa kuat. Namun, ia larut dalam campuran terkonsentrasi dari asam nitrat dan fluorororis (HNO3-HF). Demikian juga, itu larut dalam larutan alkali panas, reaksi kimia berikut terjadi:
YA (S) + 2NAOH (AC) + H2Atau (l) => na2Sio3(Ac) + 2h2(G)
Sodium Metasilicate, Na2Sio3, Itu juga terbentuk ketika silikon larut dalam natrium karbonat cair:
Ya + na2BERSAMA3(L) => na2Sio3(L) + C (s)
Pada suhu kamar itu tidak bereaksi sama sekali dengan oksigen, bahkan pada 900 ° C, ketika lapisan vitreous pelindung Siio mulai terbentuk2; Dan kemudian, pada 1400 ° C, silikon bereaksi dengan nitrogen udara untuk membentuk campuran nitrik, tanpa dan jika3N4.
Silikon juga bereaksi pada suhu tinggi dengan logam untuk membentuk silisiuro logam:
2mg (s) + ya (s) => mg2Ya s)
2cu (s) + ya (s) => cu2Ya s)
Pada suhu kamar, ia bereaksi eksplosif dan langsung dengan halogen (tidak ada lapisan sio2 yang melindunginya dari ini). Misalnya, Anda memiliki reaksi Formasi SIF4:
Ya + 2f2(g) => sif4(G)
Dan meskipun silikon tidak larut di dalam air, Red Alive bereaksi dengan arus uap:
Ya + h2Atau (g) => si2(S) + 2H2(G)
Struktur dan konfigurasi elektronik
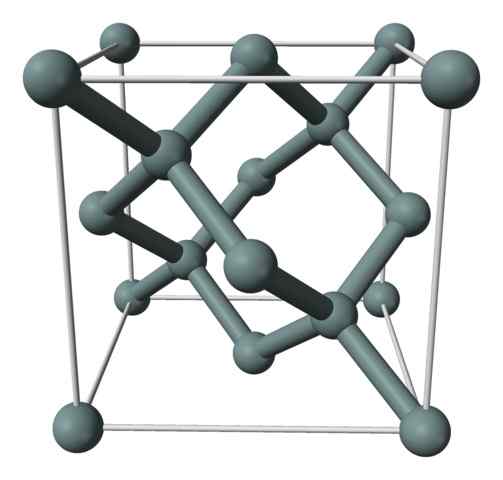 Struktur kristal atau sel kesatuan silikon diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 [Domain Publik]
Struktur kristal atau sel kesatuan silikon diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 [Domain Publik] Gambar atas menunjukkan struktur kubik yang berpusat pada wajah (FCC), sama dengan berlian, untuk kristal silikon. Bola abu -abu sesuai dengan atom jika, sebagaimana dihargai, mereka secara kovalen dihubungkan satu sama lain; Selain itu, mereka memiliki lingkungan tetrahedral yang bereproduksi di sepanjang kaca.
Kristal silikon adalah FCC karena atom diamati jika terletak di masing -masing wajah kubus (6 × 1/2). Ada juga delapan atom jika dalam simpul kubus (8 × 1/8), dan empat terletak di dalamnya (yang menunjukkan tetrahedron yang ditentukan dengan baik di sekitarnya, 4 × 1).
Mengatakan di atas, setiap sel unit memiliki total delapan atom silikon (3 + 1 + 4, angka yang ditunjukkan dalam paragraf di atas); Karakteristik yang membantu menjelaskan kekerasan dan kekakuannya yang tinggi, karena silikon murni adalah kristal kovalen serta berlian.
Karakter kovalen
Karakter kovalen ini disebabkan oleh fakta bahwa, seperti karbon, silikon memiliki empat elektron valensi sesuai dengan konfigurasi elektroniknya:
[Ne] 3s2 3p2
Untuk menautkan, orbital murni 3s dan 2p tidak berguna. Itulah mengapa atom menciptakan empat orbital hibrida SP3, Dengan mana Anda dapat membentuk empat ikatan kovalen Si-Si dan, dengan cara ini, melengkapi oktet Valencia untuk dua atom silikon.
Kristal silikon kemudian divisualisasikan sebagai jaringan kovalen dan tiga dimensi yang terdiri dari tetrahedra yang saling berhubungan.
Namun, jaringan ini tidak sempurna, karena menyajikan cacat dan batas biji -bijian, yang memisahkan dan mendefinisikan kristal dari yang lain; Dan ketika kristal -kristal seperti itu sangat kecil dan banyak, ada pembicaraan tentang padatan polyristaline, diidentifikasi dengan kecerahan heterogennya (mirip dengan mosaik atau perak permukaan yang scam.
Konduktivitas listrik
SI-IF Links, dengan elektron-elektronnya yang berlokasi baik, pada prinsipnya tidak setuju dengan apa yang diharapkan dari logam: lautan elektron "membasahi" atom mereka; Setidaknya, ini sangat pada suhu kamar.
Namun, ketika suhu meningkat, silikon mulai menggerakkan listrik dan, oleh karena itu, berperilaku seperti logam; Artinya, ini adalah elemen metaloid semikonduktor.
Silikon amorf
Tetraheders silikon tidak selalu mengadopsi pola struktural, tetapi dapat diatur dengan cara yang tidak teratur; Dan bahkan, dengan atom silikon yang hibridisasi tampaknya SP3 tapi sp2, yang berkontribusi untuk lebih meningkatkan tingkat gangguan. Oleh karena itu, ada pembicaraan tentang silikon amorf dan non -kristalin.
Pada silikon amorf ada lowongan elektronik, di mana beberapa atom mereka memiliki orbital dengan elektron menghilang. Berkat ini, padatannya dapat hidrogen itu sendiri, menimbulkan pembentukan silikon amorf hidrogen; yaitu, memiliki tautan Si-H, yang dengannya tetrahedra diselesaikan dalam posisi yang tidak teratur dan sewenang-wenang.
Dapat melayani Anda: tautan interatomikBagian ini kemudian disimpulkan dengan mengatakan bahwa silikon dapat disajikan dalam tiga jenis padatan (belum lagi tingkat kemurniannya): kristal, polyristaline dan amorf.
Masing -masing memiliki metode atau proses produksinya sendiri, serta penerapan dan dilema saat memutuskan mana dari ketiganya, mengetahui kelebihan dan kekurangannya.
Dimana itu dan dapatkan
 Kristal Kuarsa (Silika) adalah salah satu mineral utama dan paling luar biasa di mana silikon berada. Sumber: James St. John (https: // www.Flickr.com/foto/jsjgeology/22437758830)
Kristal Kuarsa (Silika) adalah salah satu mineral utama dan paling luar biasa di mana silikon berada. Sumber: James St. John (https: // www.Flickr.com/foto/jsjgeology/22437758830) Silikon adalah unsur ketujuh yang paling melimpah dari alam semesta, dan yang kedua di kerak bumi, juga memperkaya mantel bumi dengan keluarga mineral yang luas. Elemen ini sangat baik dengan oksigen, membentuk berbagai oksida; Di antara mereka, silika, jadi2, dan silikat (beragam komposisi kimia).
Silika dapat dilihat dengan mata telanjang di gurun dan pantai, karena pasirnya terutama terdiri dari Sio2. Pada gilirannya, oksida ini dapat bermanifestasi dalam beberapa polimorf, menjadi yang paling umum: kuarsa, amethyst, agate, christobalite, tripoli, coesite, stishovita dan thundimita. Selain itu, dapat ditemukan di padatan amorf seperti opal dan lahan diatomea.
Silikat, sementara itu, bahkan lebih kaya secara struktural dan kimia. Di antara beberapa mineral silikat dapat disebutkan: asbes (putih, kopi dan kebiruan), feldspar, lempung, mikia, zaitun, aluminosilikat, zeolit, amphibe dan piroksena.
Secara praktis, semua batu terdiri dari silikon dan oksigen, dengan ikatan stabil Si-O, dan silikat serta silikatnya dicampur dengan oksida logam dan spesies anorganik.
-Pengurangan Silika
Masalah yang mewakili mendapatkan silikon adalah memecahkan tautan Si-O ini, di mana oven khusus dan strategi pengurangan yang baik diperlukan. Bahan baku untuk proses ini adalah silika berbentuk kuarsa, yang sebelumnya bergerak sampai bubuk halus.
Dari silika tanah ini, dapat disiapkan baik dengan silikon amorf atau polyristaline.
Silikon amorf
Dalam skala kecil, dibuat di laboratorium dan dengan langkah -langkah yang relevan, silika dicampur dengan debu magnesium dalam pot peleburan dan dibakar tanpa adanya udara. Reaksi berikutnya terjadi kemudian:
Sio2(s) + mg (s) => 2mgo (s) + ya (s)
Magnesium dan oksida dihilangkan dengan larutan asam klorida encer. Kemudian, padatan yang tersisa diobati dengan asam fluorhorority, sehingga selesai bereaksi Sio2 Berlebihan; Kalau tidak, kelebihan magnesium mendukung pembentukan siliciuro masing -masing, mg2Ya, senyawa yang tidak diinginkan untuk prosesnya.
Sio2 Itu berubah menjadi gas volatile sif4, yang dipulihkan untuk sintesis kimia lainnya. Akhirnya, adonan silikon amorf dikeringkan di bawah arus hidrogen gas.
Metode serupa lainnya untuk mendapatkan silikon amorf adalah menggunakan SF yang sama4 sebelumnya diproduksi, atau SICL4 (sebelumnya diperoleh). Uap halogenuros silikon ini dilewatkan di atas natrium cair dalam atmosfer lembam, sehingga pengurangan gas dapat diberikan tanpa adanya oksigen:
Sicl4(g) + 4na (l) => ya (s) + 4nacl (l)
Menariknya, dengan silikon amorf, panel surya kinerja energi tinggi diproduksi.
Silikon kristal
Mulai lagi dari silika bubuk atau kuarsa, mereka dibawa ke oven busur listrik, di mana ia bereaksi dengan kokas. Dengan cara ini, zat pereduksi bukan lagi logam tetapi bahan karbon yang tinggi:
Sio2(s) + 2c (s) => ya (s) + 2co (g)
Dalam reaksi, silikon karbida juga diproduksi, sic, yang dinetralkan dengan kelebihan sio2 (Sekali lagi kuarsa itu berlebihan):
2SIC (S) + Sio2(s) => 3si + 2co (g)
Metode lain untuk menyiapkan silikon kristal adalah menggunakan aluminium sebagai zat pereduksi:
3sio2(s) + 4al (l) => 3si + 2al2SALAH SATU3(S)
Dan mulai dari kalium hexafluorurosilicate, k2[Sif6], itu juga bereaksi dengan aluminium logam atau kalium untuk menyebabkan produk yang sama:
K2[Sif6] (l) + 4al (l) => 3si (s) + 6kf (l) + 4alf3(G)
Segera silikon larut dalam aluminium cair, dan ketika sistem pendingin, yang pertama mengkristal dan terpisah dari yang kedua; yaitu, kristal silikon terbentuk, yang terlihat warna keabu -abuan.
Silikon polyristaline
Berbeda dengan sintesis atau produksi lain, untuk mendapatkan silikon polyristaline, dimulai dengan fase gas silano, SIH4. Gas ini mengalami pirolisis di atas suhu 500 ° C, sedemikian rupa sehingga dekomposisi termal terjadi dan dengan demikian, uap awalnya, mereka akhirnya menyimpan polyristal silikon pada permukaan semikonduktor.
Persamaan kimia berikut mencontohkan reaksi yang terjadi:
Ya h4(g) => ya (s) + h2(G)
Jelas, seharusnya tidak ada oksigen di dalam ruang, karena akan bereaksi dengan SIH4:
Ya h4(g) + 2nd2(g) => sio2(S) + 2H2O (g)
Dan spontanitas reaksi pembakaran adalah seperti itu, yang terjadi dengan cepat pada suhu kamar di wajah.
Rute sintetis lain untuk menghasilkan bagian silikon jenis silikon kristal ini sebagai bahan baku. Mereka membuatnya bereaksi dengan hidrogen klorida pada suhu sekitar 300 ° C, sehingga trichlorosilano terbentuk:
Dapat melayani Anda: besi (elemen): karakteristik, struktur kimia, penggunaanYa (s) + 3hcl (g) => siCl3H (g) + h2(G)
Dan SICL3H Bereaksi terhadap 1100 ºC untuk meregenerasi silikon, tetapi sekarang polyristaline:
4sicl3H (g) => ya (s) + 3sicl4(g) + 2h2(G)
Itu cukup untuk melihat persamaan untuk memberikan gambaran tentang pekerjaan dan parameter produksi yang ketat yang harus dipertimbangkan.
Isotop
Silikon secara alami dan terutama sebagai isotop 28Ya, dengan kelimpahan 92,23%.
Selain itu, ada dua isotop lain yang stabil dan karenanya tidak mengalami pembusukan radioaktif: 29Ya, dengan berlimpah 4,67%; Dan 30Ya, dengan berlimpah 3,10%. Menjadi sangat berlimpah 28Ya, tidak mengherankan bahwa berat atom silikon adalah 28.084 u.
Silikon juga bisa berada di beberapa radioisotop, di antaranya 31Ya (T1/2= 2,62 jam) dan 32Ya (T1/2= 153 tahun). Yang lain (22Ya - 44Jika mereka punya T1/2 sangat pendek atau singkat (kurang dari ratusan detik).
Risiko
Silikon murni adalah zat yang relatif lembam, sehingga biasanya tidak menumpuk di organ atau jaringan apa pun selama paparannya rendah. Dalam bentuk debu dapat menyebabkan iritasi mata, menyebabkan air mata atau kemerahan, sementara menyentuhnya dapat menyebabkan ketidaknyamanan kulit, gatal dan terkelupas.
Ketika paparan sangat tinggi, silikon dapat melukai paru -paru; Tetapi tanpa efek selanjutnya, kecuali jumlahnya cukup untuk menyebabkan mati lemas. Namun, ini tidak terjadi dengan kuarsa, yang terkait dengan kanker paru -paru dan penyakit seperti bronkitis dan emfisema.
Demikian juga, silikon murni sangat jarang di alam, dan senyawanya, begitu berlimpah di kerak bumi, tidak mewakili risiko terhadap lingkungan.
Sekarang, sehubungan dengan organ, ini bisa beracun; Tetapi memiliki banyak dari mereka bergantung pada mana yang dipertimbangkan, serta faktor -faktor lain (reaktivitas, pH, mekanisme aksi, dll.).
Aplikasi
Industri konstruksi
Mineral silikon mengintegrasikan "batu" yang dengannya bangunan, rumah, atau monumen dibangun. Misalnya, semen, beton, plesteran dan bata refraktori, terdiri dari campuran padat berdasarkan silikat. Dari pendekatan ini, seseorang dapat muncul utilitas yang dimiliki elemen ini di kota dan arsitektur.
Kaca dan Keramik
Dari silika, kristal yang digunakan pada perangkat optik dapat diproduksi, baik sebagai isolator, sel untuk sampel spektrofotometer, kristal piezoelektrik atau kacamata belaka.
Juga, ketika bahan disiapkan dengan beberapa aditif, akhirnya berubah menjadi padatan amorf, terkenal sebagai kaca; dan gunung pasir biasanya merupakan sumber silika atau kuarsa yang diperlukan untuk produksinya. Di sisi lain, dengan bahan keramik dan porselen silikat diproduksi.
Gagasan yang saling terkait, silikon juga hadir dalam kerajinan dan ornamen.
Paduan
Atom silikon dapat kohesif dan larut dengan matriks logam, sehingga merupakan aditif untuk banyak paduan atau logam; Misalnya, baja, untuk memproduksi inti magnet; perunggu, untuk pembuatan kabel telepon; dan aluminium, dalam produksi paduan aluminium-sailicio untuk bagian otomotif ringan.
Oleh karena itu, tidak hanya dapat ditemukan di "batu" bangunan, tetapi juga di logam kolom mereka.
Desiccants
 Bola silika agar -agar, digunakan sebagai pengeringan. Sumber: Desiccants [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Bola silika agar -agar, digunakan sebagai pengeringan. Sumber: Desiccants [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Silika, dalam bentuk gel atau amorf, memungkinkan untuk memproduksi padatan yang bertindak sebagai pengeringan saat menangkap molekul air yang memasuki wadah dan menjaga interiornya kering.
Industri elektronik
 Silikon polyristal dan amorf digunakan untuk pembuatan panel surya. Sumber: Pxhere.
Silikon polyristal dan amorf digunakan untuk pembuatan panel surya. Sumber: Pxhere. Lapisan silikon dengan ketebalan dan warna yang berbeda adalah bagian dari chip komputer, serta dengan padatan (kristal atau amorf), sirkuit terintegrasi dan sel surya telah dirancang.
Menjadi semikonduktor, atom dimasukkan dengan lebih sedikit (al, b, ga) atau lebih elektron (p, as, sb) untuk mengubahnya menjadi semikonduktor tipe P salah satu N, masing -masing. Dengan dua serikat silicios, satu N Dan lainnya P, Dioda emitor cahaya diproduksi.
Polimer silikon
Lem silikon yang terkenal terdiri dari polimer organik yang didukung oleh stabilitas rantai tautan Si-o-Si ... jika rantai ini sangat panjang, pendek atau silang, sifat-sifat perubahan polimer silikon, serta mereka aplikasi akhir.
Di antara penggunaannya, berikut ini dapat disebutkan di bawah ini:
-Lem atau perekat, tidak hanya untuk bergabung dengan kertas, tetapi blok konstruksi, karet, panel kaca, batu, dll.
-Pelumas dalam sistem pengereman hidrolik
-Memperkuat lukisan dan meningkatkan kecerahan dan intensitas warnanya, pada saat yang sama yang memungkinkan Anda untuk menahan perubahan suhu tanpa retak atau carcome
-Mereka digunakan sebagai semprotan penolak air, yang tetap mengeringkan beberapa permukaan atau benda
-Mereka memberikan produk kebersihan pribadi (pasta gigi, sampo, gel, krim pisau cukur, dll.) Perasaan menjadi halus
-Lapisannya melindungi komponen elektronik perangkat halus dari panas dan kelembaban, seperti mikroprosesor
-Dengan polimer silikon, beberapa bola karet yang memantul hampir tidak jatuh ke lantai.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Silikon. Diperoleh dari: di.Wikipedia.org
- Mikrokimia. (S.F.). Kristalografi silikon. Pulih dari: mikrokimia.com
- Lentech b.V. (2019). Tabel periode: silikon. Pulih dari: lentech.com
- Marques Miguel. (S.F.). Silikon terjadi. Pulih dari: nautilus.Fis.UC.Pt
- Lebih banyak hemant. (5 November 2017). Silikon. Pulih dari: hemantmore.org.di dalam
- Pilgaard Michael. (22 Agustus 2018). Silikon: Kejadian, Isolasi & Sintesis. Pulih dari: pilgaardelegs.com
- Kata. Doug Stewart. (2019). Fakta Elemen Silikon. Chemicool. Pulih dari: chemicool.com
- Christiana Honsberg dan Stuart Bowden. (2019). Kumpulan Sumber Daya untuk Pendidik Fotovoltaik. Pveducation. Diperoleh dari: pveducation.org
- American Chemistry Council, Inc. (2019). Silikon dalam kehidupan sehari -hari. Dipulihkan dari: Sehsc.AmericAchemistry.com
- « Jenis dan contoh strategi distribusi
- Jenis strategi produk, bagaimana cara melakukannya dan contohnya »

