Solusi tak jenuh
- 1186
- 54
- Herbert Fritsch
 Dalam solusi tak jenuh, setengah pelarut masih mampu melarutkan lebih banyak zat terlarut
Dalam solusi tak jenuh, setengah pelarut masih mampu melarutkan lebih banyak zat terlarut Apa itu solusi tak jenuh?
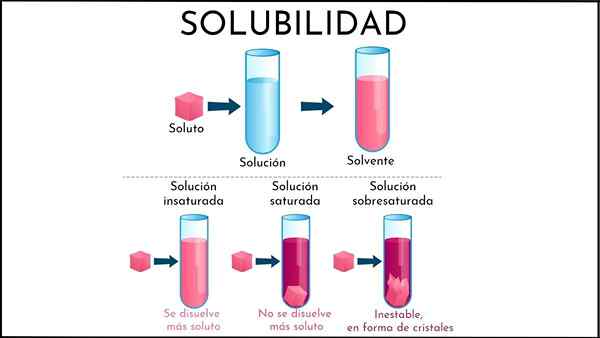
A solusi tak jenuh Itu semua solusi di mana media pelarut masih dapat melarutkan lebih banyak zat terlarut. Media ini umumnya cair, meskipun juga bisa menjadi gas. Mengenai zat terlarut, ini adalah konglomerat partikel padat atau gas.
Dan bagaimana dengan zat terlarut cair? Dalam hal ini, solusinya homogen selama kedua cairan itu larut. Contohnya adalah penambahan etil alkohol ke dalam air; Dua cairan dengan molekul mereka, Cho3Ch2Oh dan h2Atau, mereka larut karena mereka membentuk jembatan hidrogen (pilih3Ch2Oh oh2).
Namun, jika dicloromethane bercampur (pilih2Cl2) dan air, ini akan membentuk larutan dengan dua fase: satu air dan organik lainnya. Ini karena choles ch2Cl2 dan H2Atau berinteraksi dengan sangat lemah, jadi beberapa meluncur ke atas yang lain, menghasilkan dua cairan yang tidak bercampur.
Setetes minimum cho2Cl2 (terlarut) cukup untuk menjenuhkan air (pelarut). Jika, sebaliknya, mereka dapat membentuk solusi yang tidak jenuh, solusi yang benar -benar homogen akan terlihat.
Untuk alasan ini, hanya zat terlarut yang solid dan gas yang dapat menghasilkan solusi tak jenuh.
Apa itu solusi tak jenuh?
Dalam larutan tak jenuh, molekul pelarut berinteraksi dengan efektivitas sehingga molekul zat terlarut tidak dapat membentuk fase lain.
Ini berarti bahwa interaksi larut-larut melebihi, mengingat kondisi tekanan dan suhu, interaksi zat terlarut.
Setelah interaksi zat terlarut meningkat, mereka "mengatur" pembentukan fase kedua. Misalnya, jika media pelarut adalah cairan, dan zat terlarut yang padat, yang kedua akan larut pada yang pertama untuk membentuk larutan homogen, sampai fase padat muncul, yang tidak lebih dari zat terlarut yang diendapkan.
Itu dapat melayani Anda: polymethylmetacrylateEndapan ini disebabkan oleh fakta bahwa molekul zat terlarut berhasil dikelompokkan berdasarkan sifat kimianya, intrinsik dengan struktur atau tautannya. Ketika ini terjadi, dikatakan bahwa solusinya jenuh dengan zat terlarut.
Oleh karena itu, solusi zat terlarut yang tidak jenuh terdiri dari fase cair tanpa endapan. Sementara jika zat terlarutnya adalah gas, maka solusi tak jenuh harus bebas dari keberadaan gelembung (yang tidak lebih dari kelompok minuman ringan).
Efek suhu
Suhu secara langsung mempengaruhi tingkat tidak jenuh larutan sehubungan dengan zat terlarut.
Ini terutama dapat disebabkan oleh dua alasan: melemahnya interaksi zat terlarut karena efek panas, dan peningkatan getaran molekuler yang membantu membubarkan molekul zat terlarut.
Jika media pelarut dianggap sebagai ruang kompak di mana lubang molekul zat terlarut ditempatkan, suhu meningkat, molekul akan bergetar meningkatkan ukuran lubang ini; sedemikian rupa sehingga zat terlarut dapat menuju ke arah lain.
Padatan yang tidak larut
Namun, beberapa zat terlarut memiliki interaksi yang kuat, bahwa molekul pelarut hampir tidak mampu memisahkannya.
Ketika demikian, konsentrasi minimal dari zat terlarut tersebut cukup untuk mengendap, dan kemudian merupakan padatan yang tidak larut.
Padatan yang tidak larut, dengan membentuk fase padat kedua yang berbeda dari fase cair, menghasilkan beberapa larutan tak jenuh.
Misalnya, jika 1L cairan A dapat melarutkan hanya 1g b tanpa mengendapkan, maka saat mencampur 1L A dengan 0.5 g B akan menghasilkan solusi tak jenuh.
Itu bisa melayani Anda: hidrokoloidDemikian pula, peringkat konsentrasi berkisar antara 0 dan 1g B juga membentuk solusi tak jenuh. Tapi setelah 1G, B akan mengendap. Saat ini terjadi, solusinya berubah dari tidak jenuh menjadi jenuh dari B.
Jika larutan jenuh dengan 1 diserahkan ke pemanasan.5g B, panas akan membantu pembubaran endapan. Namun, jika ada banyak b yang diendapkan, panas tidak bisa melarutkannya.
Jika demikian, peningkatan suhu hanya akan menguapkan pelarut atau cairan.
Contoh solusi tak jenuh
Contoh solusi tak jenuh banyak, karena mereka bergantung pada pelarut dan terlarut. Misalnya, untuk cairan yang sama A, dan zat terlarut lainnya C, D, E ... Z, solusi mereka akan tidak jenuh selama mereka tidak mengendapkan atau membentuk gelembung (jika mereka adalah zat terlarut gas).
-Laut dapat menyumbangkan dua contoh. Air laut adalah solusi penyelamatan besar -besaran. Jika Anda menempatkan sedikit air ini, akan dicatat bahwa itu tidak jenuh tanpa adanya garam yang diendapkan. Namun, saat air menguap, ion yang terlarut mulai dikelompokkan, meninggalkan Saltpeter menempel pada panci.
-Contoh lain adalah pembubaran oksigen di dalam air laut. Molekul O2 Frank kedalaman laut yang cukup untuk menghirup fauna laut, meskipun sedikit larut.
Karena alasan ini adalah umum untuk mengamati gelembung oksigen yang muncul ke permukaan; di antaranya, beberapa molekul berhasil larut.
Situasi serupa terjadi dengan molekul karbon dioksida, CO2. Tidak seperti o2, CO2 Ini sedikit lebih larut karena bereaksi dengan air untuk membentuk asam karbonat, h2BERSAMA3.
Dapat melayani Anda: sistem materialPerbedaan dengan solusi jenuh
Meringkas yang baru dijelaskan, apa perbedaan antara solusi tak jenuh dan jenuh? Pertama, aspek visual: solusi tak jenuh terdiri dari satu fase. Oleh karena itu, seharusnya tidak ada adanya padatan (fase padat) atau gelembung (fase soda).
Juga, konsentrasi zat terlarut dalam larutan tak jenuh dapat bervariasi sampai endapan atau gelembung terbentuk. Saat berada di jenuh, larutan biphasic (cairan-padat atau cair-gaseous), konsentrasi zat terlarut adalah konstan.
Karena? Karena partikel (molekul atau ion) yang membentuk endapan, menetapkan keseimbangan dengan yang dilarutkan dalam pelarut:
Partikel dari partikel endapan terlarut
Molekul gelembung molekul terlarut
Skenario ini tidak direnungkan dalam solusi tak jenuh. Saat mencoba melarutkan lebih banyak zat terlarut dalam larutan jenuh, keseimbangan bergerak ke kiri; untuk pembentukan lebih banyak endapan atau gelembung.
Karena dalam solusi tak jenuh keseimbangan ini (saturasi) belum ditetapkan (saturasi) dapat "menyimpan" lebih padat atau gas.
Di sekitar ganggang di dasar laut ada oksigen terlarut, tetapi ketika gelembung oksigen dilahirkan dari daunnya, itu berarti saturasi gas terjadi; Kalau tidak, gelembung tidak akan diamati.
Referensi
- Kimia Umum. materi pengajaran. Lima: Universitas Katolik Kepausan Peru. Pulih dari: Korintus.PUCP.Edu.pe
- Helmestine, Anne Marie, PH.D. (2018). Definisi solusi tak jenuh. Pulih dari: thinkco.com
- Tutorvista (s.F.). Solusi tak jenuh. Diambil dari: Kimia.Tutorvista.com
- Libretteks kimia (s.F.). Jenis saturasi. Pulih dari: chem.Librettexts.org
- Nadine James. (2018). Solusi tak jenuh: Definisi & contoh. Pulih dari: belajar.com

