Buteno

- 4546
- 265
- Mr. Darrell Streich
 Struktur kimia buutene
Struktur kimia buutene Apa buteno?
Dia Buteno Itu adalah nama yang menerima serangkaian empat isomer dengan formula kimia C4H8. Mereka adalah alkena atau olefin, yaitu, mereka memiliki ikatan rangkap C = C dalam strukturnya. Selain itu, mereka adalah hidrokarbon, yang dapat ditemukan dalam endapan minyak atau berasal dari retak termal dan mendapatkan produk dengan berat molekul yang lebih rendah.
Keempat isomer bereaksi dengan oksigen melepaskan panas dan api kuning. Mereka juga dapat bereaksi dengan spektrum luas molekul kecil yang ditambahkan ke ikatan rangkap mereka.
Tapi apa isomer buteno? Pada gambar atas, struktur dengan bola putih (hidrogen) dan hitam (karbon) diwakili untuk 1-butene. 1-butene adalah isomer paling sederhana dari hidrokarbon C4H8.
Perhatikan bahwa ada delapan bidang putih dan empat bidang hitam, yang setuju dengan formula kimia.
Tiga isomer lainnya adalah cis dan trans 2-butene, dan iso-butene. Semuanya menunjukkan sifat kimia yang sangat mirip, meskipun strukturnya menyebabkan variasi sifat fisik (titik fusi dan didih, kepadatan, dll.).
Juga, spektrum mereka memiliki pola pita penyerapan yang sama.
Bahasa sehari-hari, 1-butene dinamai Buteno, meskipun 1-butene hanya mengacu pada satu isomer dan bukan nama generik. Keempat senyawa organik ini adalah gas, tetapi dapat dicairkan dengan tekanan tinggi atau condens.
Mereka adalah sumber panas dan energi, reagen untuk sintesis senyawa organik lainnya dan, di atas segalanya, diperlukan untuk pembuatan karet buatan setelah sintesis butadiene.
Sifat fisik dan kimia buteno
Berat molekul
56.106 g/mol. Berat ini sama untuk semua isomer formula C4H8.
Aspek fisik
Ini adalah gas yang tidak berwarna dan mudah terbakar (seperti isomer lainnya), dan memiliki aroma yang relatif aromatik.
Titik didih
Titik mendidih untuk isomer buteno adalah sebagai berikut:
1 -tebute: -6º C
CIS-2-Butene: 3.7 C
Trans-2-butene: 0.96º c
2 -methylpropene: -6.9º c
Titik lebur
1 -tua: -185.3 c
CIS-2-Butene: -138.9º c
Trans-2-butene: -105.5 c
2 -methylpropeno: -140.4 c
Kelarutan
Buteno sangat tidak larut dalam air karena sifat apolarnya. Namun, itu larut dalam beberapa alkohol, seperti benzena, toluena dan eter.
Kepadatan
0.577 hingga 25º C. Oleh karena itu, itu kurang padat dari air dan dalam wadah itu akan terletak di atas yang sama.
Reaktivitas
Seperti alkena lainnya, ikatan rangkapnya rentan untuk menambahkan molekul atau pengoksidasi. Ini membuat buteno dan isomernya reaktif. Di sisi lain, mereka adalah zat yang mudah terbakar, jadi sebelum suhu berlebih mereka bereaksi dengan oksigen udara.
Dapat melayani Anda: butanal: struktur, sifat, penggunaan dan risikoStruktur kimia buutene
Pada gambar atas struktur 1-butene diwakili. Di sebelah kiri Anda, Anda dapat melihat lokasi ikatan rangkap antara karbon pertama dan kedua.
Molekul memiliki struktur linier, meskipun wilayah di sekitar tautan C = C datar karena hibridisasi SP2 dari karbon ini.
Jika molekul 1-butene diputar pada sudut 180º, molekul yang sama tidak akan memiliki perubahan yang jelas, oleh karena itu, ia tidak memiliki aktivitas optik.
Bagaimana molekul Anda berinteraksi? Tautan C-H, C dan C-C adalah sifat apolar, jadi tidak ada yang berkolaborasi dalam pembentukan momen dipol.
Akibatnya, molekul CHO2= Chch2Ch3 Mereka harus berinteraksi melalui kekuatan dispersi London.
Ujung kanan butene membentuk dipol instan, yang pada jarak pendek mempolarisasi atom yang berdekatan dari molekul tetangga. Di sisi lain, ujung kiri tautan C = C, berinteraksi tumpang tindih awan π di atas yang lain (seperti dua wafer atau lembar).
Karena ada empat atom karbon yang menyusun kerangka molekul, interaksinya hampir tidak cukup untuk fase cair memiliki titik didih -6º C.
Isomer konstitusional dan geometris
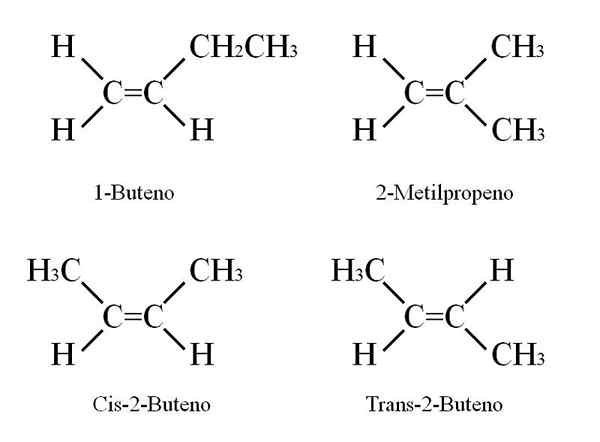 Struktur Butenous. Sumber: Gabriel Bolívar
Struktur Butenous. Sumber: Gabriel Bolívar 1-butene memiliki formula molekul C4H8; Namun, senyawa lain mungkin memiliki proporsi atom C dan H yang sama.
Bagaimana itu mungkin? Jika struktur 1-butene diamati dengan hati-hati, substituen karbon C = C dapat dipertukarkan. Pertukaran ini menghasilkan senyawa lain dari kerangka yang sama.
Selain itu, posisi ikatan rangkap antara C-1 dan C-2 dapat bergerak menuju C-2 dan C-3: CH3Ch = chch3, 2-butene.
Dalam 2-butene, atom H dapat ditempatkan pada sisi yang sama dari ikatan rangkap, yang sesuai dengan stereoisomer CIS; atau dalam orientasi spasial yang berlawanan, dalam stereoisomer trans. Keduanya merupakan apa yang juga dikenal sebagai isomer geometris. Hal yang sama berlaku untuk grup -ch3.
Demikian juga, perhatikan bahwa jika dibiarkan dalam molekul Cho3Ch = chch3 Atom H di satu sisi, dan kelompok CH3 Di yang lain, isomer konstitusional akan diperoleh: ch2= C (ch3)2, 2-metilpropen (juga dikenal sebagai iso-butene).
Dapat melayani Anda: kalium nitrat (KNO3)Keempat senyawa ini memiliki formula C yang sama4H8 Tetapi struktur yang berbeda. 1-butene dan 2-methylpropene adalah isomer konstitusional; dan cis dan trans-2-butene, isomer geometris di antara mereka berdua (dan konstitusional sehubungan dengan yang lain).
Stabilitas
Panas pembakaran
Dari gambar atas, manakah dari empat isomer yang mewakili struktur yang paling stabil? Jawabannya dapat ditemukan, misalnya, dalam pemanasan pembakaran masing -masing.
Saat bereaksi dengan oksigen, isomer dengan formula C4H8 diubah menjadi CO2 Melepaskan air dan panas:
C4H8(g) + 6o2(g) => 4co2(g) + 4h2O (g)
Pembakaran adalah eksotermik, jadi semakin banyak panas yang dilepaskan, semakin tidak stabil hidrokarbon. Oleh karena itu, dari empat isomer yang melepaskan lebih sedikit panas untuk terbakar di udara, akan menjadi yang paling stabil.
Pembakaran memanaskan untuk keempat isomer adalah:
-1-butene: 2717 kJ/mol
-CIS-2-Butene: 2710 kJ/mol
-Trans-2-butene: 2707 kJ/mol
-2-metilpropeno: 2700 kJ/mol
Perhatikan bahwa 2-metilpropen adalah isomer yang mengeluarkan lebih sedikit panas. Sedangkan 1-butene adalah salah satu yang melepaskan panas terbanyak, yang diterjemahkan menjadi ketidakstabilan yang lebih besar.
Efek sterik dan elektronik
Perbedaan stabilitas antara isomer ini dapat dikurangkan langsung dari struktur kimia.
Menurut alkena, orang yang memiliki substituen paling besar memperoleh stabilisasi yang lebih besar dari ikatan rangkapnya. Dengan demikian, 1-butene adalah yang paling tidak stabil karena hampir tidak memiliki substituen (-ch2Ch3); Artinya, monosustuido (rhc = cho2).
Isomer CIS dan trans dari 2-butene berbeda dalam energi karena tegangan dinding van der yang berasal dari efek sterik.
Di isomer cis, kedua kelompok ch3 Di sisi yang sama dari ikatan rangkap mereka saling mengusir, sedangkan di isomer trans, ini cukup jauh dari satu sama lain.
Tapi mengapa kemudian 2-metilpropen adalah isomer yang paling stabil? Karena efek elektronik menjadi perantara.
Dalam hal ini, meskipun merupakan alkena yang terlarut, kedua kelompok CH3 Mereka berada dalam karbon yang sama; dalam posisi geminal tentang yang lain.
Kelompok -kelompok ini menstabilkan karbon ikatan rangkap yang memberikannya bagian dari awan elektronik mereka (karena relatif lebih asam dengan memiliki hibridisasi SP2).
Selain itu, dalam 2-butene dua isomernya hanya memiliki karbon ke-2; Sedangkan 2-metilpropen mengandung karbon ke-3, dari stabilitas elektronik yang lebih besar.
Dapat melayani Anda: Struktur Bahan: Konsep dan ContohKekuatan antarmolekul
Stabilitas keempat isomer mengikuti urutan logis, tetapi hal yang sama tidak terjadi dengan kekuatan antarmolekul. Jika titik peleburan dan didih mereka dibandingkan, mereka akan menemukan bahwa mereka tidak mematuhi urutan yang sama.
Diharapkan bahwa trans-2-butene akan menghadirkan kekuatan antarmolekul terbesar untuk memiliki kontak permukaan yang lebih besar antara dua molekul, tidak seperti cis-2-butene, yang kerangkanya menarik c. Namun, cis-2-butena mendidih pada suhu yang lebih tinggi (3.7 C), bahwa isomer trans (0.96º C).
Titik didih yang serupa untuk 1-butene dan 2-methylpropene akan mengharapkannya karena mereka secara struktural sangat mirip. Namun, dalam keadaan padat perbedaan perubahan secara radikal. The 1 -tebutene meleleh ke -185.3º C, sedangkan 2 -methylpropene di -140.4 c.
Selain itu, isomer CIS-2-butene meleleh ke -138.9º C, pada suhu yang sangat dekat dengan 2-metilpropen, yang dapat berarti bahwa dalam padatan mereka memiliki pengaturan yang sama stabilnya.
Dari data ini dapat disimpulkan bahwa, meskipun mengetahui struktur yang paling stabil, mereka tidak memberi cukup cahaya dalam pengetahuan tentang bagaimana kekuatan antarmolekul beroperasi dalam cairan; Dan bahkan lebih, dalam fase padat isomer ini.
Butenus menggunakan
-Butenian, mengingat panasnya pembakarannya, dapat dengan mudah digunakan sebagai sumber panas atau bahan bakar. Dengan demikian, diharapkan bahwa nyala api 1-butene lebih dari isomer lainnya.
-Mereka dapat digunakan sebagai pelarut organik.
-Mereka berfungsi sebagai aditif untuk meningkatkan tingkat oktan bensin.
-Dalam sintesis organik, 1-butene berpartisipasi dalam produksi senyawa lain seperti: butylene oxide, 2-glutanol, succinimida dan terbutilmecaptano (digunakan untuk memberi gas dapur aroma karakteristiknya).
Juga, dari isomer butene Anda bisa mendapatkan butadieno (cho2= Ch-ch = ch2), yang karet buatannya disintesis.
Di luar sintesis ini, keragaman produk akan tergantung pada molekul mana yang ditambahkan ke ikatan rangkap.
Misalnya, alkil halida dapat disintesis jika mereka bereaksi dengan halogen; alkohol, jika mereka menambahkan air dalam media asam; dan Butler ketiga jika mereka menambahkan alkohol dengan berat molekul rendah (seperti metanol).
Referensi
- Francis a. Tortoiseshell. Kimia organik. Asam karboksilat (edisi keenam, halaman 863-866). MC Graw Hill.
- Wikipedia (2018). Buteno. Diambil dari: itu.Wikipedia.org
- YPF (Juli). BUTENIANS. [PDF]. Diambil dari: ypf.com
- William Reusch (2013). Reaksi tambahan dari alkes. Pulih dari: 2.Kimia.MSU.Edu
- Pubchem (2018). 1-butene. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah

